Tại sao không điều chế canxi hiđroxit sẵn mà khi nào làm thí nghiệm mới điều chế

Những câu hỏi liên quan
Hãy trình bày các phương pháp điều chế khí oxi trong phòng thí nghiệm và trong công nghiệp. Tại sao không áp dụng phương pháp điều chế khí trong phòng thí nghiệm, và ngược lại?
Điều chế oxi:
- Trong phòng thí nghiệm, oxi được điều chế bằng cách phân hủy những hợp chất giàu Oxi và ít bên với nhiệt như KMnO4, KClO3, ...
2KMnO4 → K2MnO4 + MnO2 + O2
2KClO3 → 2KCl + 3O2
- Trong công nghiệp:
a) Từ không khí: Không khí sau khi đã loại bỏ hết hơi nước, khí CO2, được hóa lỏng dưới áp suất 200 atm đồng thời hạ thấp nhiệt độ. Chưng cất phân đoạn không khí lỏng, thu được oxi lỏng. Oxi lỏng được vận chuyển trong những bình thép có thể tích 100 lít dưới áp suất 150atm.
b) Từ nước. Điện phân nước: 2H2O
Người ta không áp dụng phương pháp phòng thí nghiệm cho phòng thí nghiệm vì trong phòng thí nghiệm chỉ điều chế lượng nhỏ oxi, còn công nghiệp cần một lượng lớn giá thảnh rẻ.
Đúng 0
Bình luận (0)
a) vì sao không dùng Na, Kali...để điều chế Hiddro trong phòng thí nghiêm?
b)làm cách nào để bảo quản Na trong phòng thí nghiệm?
a) Natri,Kali,... là kim loại có tính khử mạnh, phản ứng mãnh liệt với nước ở nhiệt độ thường và gây nổ lớn. Do đó không dùng Na,Kali,... để điều chế hidro trong phòng thí nghiệm
b) Bảo quản Na trong phòng thí nghiệm bằng cách ngâm vào dầu hỏa.
Đúng 2
Bình luận (0)
Cho hình vẽ điều chế HNO3 trong phòng thí nghiệm: Phát biểu nào sau đây không đúng khi nói về qua trình điều chế HNO3 trong hình vẽ trên? A. HNO3 có nhiệt độ sôi thấp (83°C) nên dễ bị bay hơi khi đun nóng B. Đốt nóng bình cầu bằng đèn cồn giúp phản ứng xảy ra nhanh hơn C. HNO3 là axit yếu hơn H2SO4 nên bị đẩy ra khỏi muối D. HNO3 sinh ra dưới dạng hơi nên cần làm lạnh để ngưng tụ
Đọc tiếp
Cho hình vẽ điều chế HNO3 trong phòng thí nghiệm:
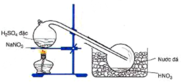
Phát biểu nào sau đây không đúng khi nói về qua trình điều chế HNO3 trong hình vẽ trên?
A. HNO3 có nhiệt độ sôi thấp (83°C) nên dễ bị bay hơi khi đun nóng
B. Đốt nóng bình cầu bằng đèn cồn giúp phản ứng xảy ra nhanh hơn
C. HNO3 là axit yếu hơn H2SO4 nên bị đẩy ra khỏi muối
D. HNO3 sinh ra dưới dạng hơi nên cần làm lạnh để ngưng tụ
Trong phòng thí nghiệm người ta điều chế hidro như thế nào? Tại sao các kim loại như Na, K, Ca, Ba hay PB, Sn tác dụng với dung dịch axit sinh ra khí hidro nhưng không được sử dụng để điều chế khí hidro?
Xem chi tiết
+) Điều chế hidro trong PTN bằng cách lấy kim loại đứng trước H tác dụng với dd axit như HCl hay H2SO4 (loãng), sau đó thu khí hidro bằng cách đẩy không khí hoặc đẩy nước
+) Người ta không dùng các kim loại như Na, K, Ba, Ca hay Pb và Sn vì những kim loại này có giá thành đắt và một số lý do khác như: Pb không tan trong HCl và tan trong H2SO4 không tạo hidro, còn các kim loại kiềm và kiềm thổ p/ứ mãnh liệt với nước trong dd gây nguy hiểm khi điều chế ...
Đúng 1
Bình luận (0)
trong phòng thí nghiệm sau khi điều chế oxi,người ta tiến hành thu khí oxy bằng phương pháp đẩy nước .tại sao họ lại làm như thế
Cho hình vẽ mô tả thí nghiệm điều chế HNO3 trong phòng thí nghiệm như sau:Hình. Điều chế HNO3 trong phòng thí nghiệmPhát biểu không đúng về quá trình điều chế là A. Có thể thay H2SO4 đặc bởi HCl đặc. B. Dùng nước đá để ngung tụ hơi HNO3. C. Đun nóng bình phản ứng để tốc độ của phản ứng tăng. D. HNO3 là một axit có nhiệt độ sôi thấp nên dễ bay hơi khi đun nóng.
Đọc tiếp
Cho hình vẽ mô tả thí nghiệm điều chế HNO3 trong phòng thí nghiệm như sau:
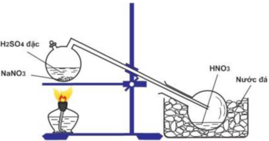
Hình. Điều chế HNO3 trong phòng thí nghiệm
Phát biểu không đúng về quá trình điều chế là
A. Có thể thay H2SO4 đặc bởi HCl đặc.
B. Dùng nước đá để ngung tụ hơi HNO3.
C. Đun nóng bình phản ứng để tốc độ của phản ứng tăng.
D. HNO3 là một axit có nhiệt độ sôi thấp nên dễ bay hơi khi đun nóng.
tại sao khi cho glucozo tác dụng với Cu(OH)2 thì phải điều chế Cu(OH)2 từ CuSO4 0,5% và NaOH 10% mà không sử dụng Cu(OH)2 có sẵn?
Thứ nhất, có thể Cu(OH)2 có sẵn có thể lẫn tạp chất do bảo quản không tốt
thứ hai là khả năng tạo phức của ion Cu2+ mới sinh dễ dàng hơn dạng tinh thể hidrat hoá.
thứ ba là phản ứng này thực hiện trong môi trường kiềm nên khi điều chế ta dùng dư NaOH
Đúng 1
Bình luận (2)
viết các pthh điều chế:
1.canxi hiđroxit từ đá vôi, nước
2. natri hiđroxit từ natri, oxi, hiđro
1.
\(CaCO_3\underrightarrow{^{^{t^0}}}CaO+CO_2\)
\(CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
2.
\(4Na+O_2\underrightarrow{^{^{t^0}}}2Na_2O\)
\(2H_2+O_2\underrightarrow{^{^{t^0}}}2H_2O\)
\(Na_2O+H_2O\rightarrow2NaOH\)
Đúng 3
Bình luận (0)
Trong phòng thí nghiệm, khi điều chế khi Oxi vào trong 1 lọ. Làm thế nào để nhận biết khí oxi khi nxi đầy binh?


















