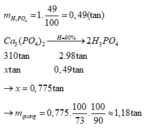Những câu hỏi liên quan
Một loại quặng bôxit chứa 48,5% Al2O3. Từ 1 tấn quặng bôxit nói trên có thể điều chế được bao nhiêu kilôgam nhôm ? (Biết hiệu suất của quá trình điều chế là 90% ).
Giải thích từng bước giùm mik nha!!
\(m_{Al_2O_3}=1000000\cdot48,5\%=485000\left(g\right)\\ n_{Al_2O_3}=\dfrac{485000}{102}\approx4750\left(mol\right)\\ PTHH:2Al_2O_3\rightarrow4Al+3O_2\\ \Rightarrow n_{Al}=2n_{Al_2O_3}=9500\left(mol\right)\\ \Rightarrow m_{Al}=9500\cdot27=256500\left(g\right)=256,5\left(kg\right)\\ \Rightarrow m_{Al\left(\text{thực tế}\right)}=256,5\cdot90\%=230,85\left(kg\right)\)
Đúng 2
Bình luận (0)
Từ 1 tấn quặng boxit chứa 48,5% nhôm oxit sản xuất được bao nhiêu tấn nhôm . Biết hiệu suất quá trình là 90% .Nêu vai trò của criolit
Xem chi tiết
Khối lượng của Al2O3 trong 1 tấn quặng = 48,5%.1000 = 0,485 tấn
2Al2O3 (điện phân nóng chảy )--> 4Al + 3O2
=> mAl = \(\dfrac{0,485.4}{102.2}.27\)= 0,257 tấn
Do hiệu suất phản ứng là 90% => mAl thực tế thu được = 0,257.90% =0,231 tấn
vài trò criolit trong quá trình điện phân là tạo hỗn hợp có nhiệt độ nóng chảy thấp ; làm tăng độ dẫn điện ;tạo xỉ, ngăn nhôm nóng chảy bị oxi hóa trong không khí.
Đúng 0
Bình luận (0)
Một loại quặng boxit chứa 51% A12O3. Từ 1 tấn quặng boxit nói trên có thể điều chế được bao nhiêu kg nhôm? (Biết hiệu suất của quá trình điều chế là 90%)
m Al2O3=1.51%=0,51(tấn)=510(kg)
2Al2O3--->4Al+3O2
1 mol Al2O3 sản xuất được 2mol nhôm
204g Al2O3 ---------------------54g nhôm
Vậy 510kg-Al2o3 sản xuất dc \(\frac{510.54}{204}=135\left(kg\right)\)
Do H=90%
--> m Al=135.90%=121,5(kg)
Đáng nhé là 48,5% mới đúng chứ nhỉ?
Người ta dùng quặng boxit để sản xuất Al. Hàm lượng Al 2 O 3 trong quặng là 40%. Để có được 4 tấn nhôm nguyên chất cần bao nhiêu tấn quặng ? Biết rằng hiệu suất của quá trình sản xuất là 90%.
Thực tế do một số nguyên nhân, chất tham gia phản ứng không tác dụng hết, nghĩa là hiệu suất dưới 100%. Người ta có thể tính hiệu suất phản ứng như sau :
1. Dựa vào một trong các chất tham gia phản ứng, công thức tính :

2.Dựa vào một trong các chất tạo thành, công thức tính :
2 Al 2 O 3 → 4Al + 3 O 2
Dựa vào phương trình ta có: Cứ 204g Al 2 O 3 thì tạo ra 108g Al
⇒ Để tạo ra 4 tấn Al thì khối lượng Al 2 O 3 cần = 4.204/108 = 7,55g
Hiệu suất phản ứng là 90%, có nghĩa là 7,55 tấn Al 2 O 3 chỉ chiếm 90% khối lượng phải dùng.
Khối lượng oxit phải dùng : 7,55x100/90 = 8,39 tấn
Khối lượng quặng boxit: 8,39x100/40 = 20,972 tấn
Đúng 2
Bình luận (0)
để có được 2,7 tấn nhôm nguyên chất cần bao nhiêu tấn quặng boxit chứa 80% nhôm oxit. Biết hiệu suất H của quá trình là 90%
2,7 tấn = 2700 kg
$n_{Al} = \dfrac{2700}{27} = 100(kmol)$
$\Rightarrow n_{Al_2O_3} = \dfrac{1}{2}n_{Al} = 50(kmol)$
$m_{Al_2O_3} = 50.102 = 5100(kg)$
$\Rightarrow m_{Al_2O_3\ đã\ dùng} = 5100 : 90\% = 5666,67(kg)$
$\Rightarrow m_{boxit} = 5666,67 : 80\% = 7083,3375(kg)$
Đúng 1
Bình luận (0)
Một loại quặng bôxit chứa 48,5% Al2O3 từ 1 tấn quặng bôxit nên có thể điều chế được bao nhiêu kilôgam nhôm (biết hiệu suất của quá trình điều chế là 90%)
Một loại quặng bôxit chứa 48,5% Al2O3. Từ 1 tấn quặng bôxit nói trên có thể điều chế được bao nhiêu kilôgam nhôm ? (Biết hiệu suất của quá trình điều chế là 90% ).
1tấn quặng nhôm bôxit chứa 48,5% nhôm oxit --> khối lượng nhôm oxit: 0,485 tấn.
Đem đi điện phân nóng chảy: 2Al2O3 ---> 4Al +3O2
vậy cứ 1mol Al2O3 cho 2 mol Al; hay 102g nhôm oxit cho 54 g Al
Hiệu suất PƯ là 90% --> khối lượng nhôm thu đc: 0,485.54.90%:102=23,1g
Đúng 0
Bình luận (0)
Từ quặng photphorit, có thể điều chế axit photphoric theo sơ đồ sau: Biết hiệu suất chung của cả quá trình là 90%. Để điều chế được 1 tấn dung dịch H3PO4 49%, cần bao nhiêu tấn quặng photphorit chứa 73% Ca3(PO4)2 về khối lượng? A. 1,32tấn B. 1,23tấn C. 1,81tấn D. 1,18tấn
Đọc tiếp
Từ quặng photphorit, có thể điều chế axit photphoric theo sơ đồ sau:
![]()
Biết hiệu suất chung của cả quá trình là 90%. Để điều chế được 1 tấn dung dịch H3PO4 49%, cần bao nhiêu tấn quặng photphorit chứa 73% Ca3(PO4)2 về khối lượng?
A. 1,32tấn
B. 1,23tấn
C. 1,81tấn
D. 1,18tấn
Trong một loại quặng boxit có 50% nhôm oxit. Nhôm luyện từ oxit đó còn chứa 1,5% tạp chất. Tính lượng nhôm thu được khi luyện 0,5 tấn quặng boxit trên. Hiệu suất phản ứng 100%.
Lượng nhôm oxit có trong 0,5 tấn quặng là : 0,5x50/100 = 0,25 tấn = 250kg
Phương trình hoá học điều chế Al :
2 Al 2 O 3 → 4Al + 3 O 2
Khối lượng Al nguyên chất thu được từ 250 kg quặng :
x = 250x4x27/(2x102) = 132,4(kg)
Khối lượng Al lẫn tạp chất: 132,4 x 101,5% = 134,386 (kg).
Đúng 0
Bình luận (0)