Tại sao phải dẫn khí đi qua ống nghiệm có nhánh đựng dung dịch NaOH trong Thí nghiệm 1 (Hình 13.5)?

Nêu hiện tượng và viết phương trình hóa học xảy ra (nếu có) trong các thí nghiệm sau:
Thí nghiệm 1:Dẫn khí hidro đi qua ống đựng bột đồng (II) oxit nung nóng
Thí nghiệm 2:Nhỏ dung dịch Na^2CO^3 vào ống nghiệm đựng nước vôi trong
Thí nghiệm 3:Nhỏ dung dịch HCL vào ống nghiện đựng CaCO^3
Thí nghiệm 4:Nhỏ dung dịch H^2SO^4 loãng vào ống nghiệm đựng kim loại đồng
Thí nghiệm 5:Nhỏ dung dịch HCL loãng vào ống nghiệm đựng kim lạo nhôm
TN1: Hiện tượng: chất rắn màu đen chuyển thành màu nâu đỏ.
PTHH: H2 + CuO to→ Cu + H2O
TN2: Hiện tượng: xuất hiện kết tủa trắng.
PTHH: Na2CO3 + Ca(OH)2 → CaCO3↓ + 2NaOH
TN3: Hiện tượng: chất rắn tan, có bọt khí không màu bay ra.
PTHH: CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
TN4: Hiện tượng: không có hiện xảy ra.
TN5: Hiện tượng: chất rắn tan, có bọt khí không màu bay ra.
PTHH: 6HCl + 2Al → 2AlCl3 + 3H2↑
Chuẩn bị: Ethanol, dung dịch sulfuric acid đặc, nước bromine, dung dịch KMnO4 1%, dung dịch NaOH đặc; ống nghiệm, giá thí nghiệm, ống dẫn khí hình chữ L, ống dẫn khí hình chữ Z có một đầu được vuốt nhọn, đèn cồn, bông.
Tiến hành: Cho 2 mL ethanol vào ống nghiệm khô, thêm dần từng giọt 4 mL dung dịch sulfuric acid đặc (cho chảy dọc theo thành ống nghiệm), lắc đều. Cho vào ống nghiệm một ít cát hoặc 1 – 2 mảnh sứ xốp. Kẹp ống nghiệm lên giá và lắp với ống dẫn khí hình chữ L qua phần ống nối có mẩu bông tẩm dung dịch NaOH đặc. Đun nóng ống nghiệm và sục ống dẫn khí vào ống nghiệm có chứa khoảng 1 mL nước bromine. Khi nước bromine bị mất màu thì thay ống nghiệm bằng ống nghiệm khác có chứa 1 mL dung dịch KMnO4 1%. Khi màu tím biến mất thì thay ống dẫn khí hình chữ L bằng ống dẫn khí hình chữ Z (đầu được vuốt nhọn hướng lên phía trên) và đốt khí thoát ra ở đầu ống dẫn khí.
Yêu cầu: Quan sát, viết phương trình hoá học và giải thích hiện tượng xảy ra.

- Hiện tượng: khí sinh ra làm mất màu nước bromine, thuốc tím, khi đốt cháy tỏa ra nhiều nhiệt.
- Giải thích hiện tượng: Khí ethylene sinh ra từ phản ứng tách nước ethanol (xúc tác sulfuric acid đặc), ethylene phản ứng với dung dịch bromine và dung dịch thuốc tím, làm mất màu hai dung dịch trên. Khi đốt cháy khí ethylene, phản ứng tỏa ra nhiều nhiệt.
- Phương trình hóa học:

Tiến hành thí nghiệm điều chế và thử tính chất của chất X theo các bước sau đây:
➢ Bước 1: Cho vài mẩu nhỏ canxi cacbua vào ống nghiệm đã đựng 1 ml nước và đậy nhanh bằng nút có ống dẫn khí đầu vuốt nhọn.
➢ Bước 2: Đốt khí sinh ra ở đầu ống vuốt nhọn.
➢ Bước 3: Dẫn khí qua ống nghiệm đựng dung dịch KMnO4 và dung dịch AgNO3 trong NH3.
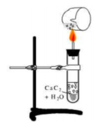
Có các phát biểu sau:
(a) Có thể thay canxi cacbua bằng đất đèn.
(b) Khí X sinh ra trong thí nghiệm còn được gọi là “khí đất đèn”, có khả năng bảo quản hoa quả tươi lâu hơn.
(c) Khi cháy, X toả nhiều nhiệt nên được dùng trong đèn xì để hàn, cắt kim loại.
(d) Dẫn khí X đến dư qua dung dịch KMnO4, màu tím nhạt dần để lại trong ống nghiệm dung dịch trong suốt, không màu.
(e) Dẫn khí X qua dung dịch AgNO3 trong NH3 thấy tạo thành kết tủa là sản phẩm của phản ứng tráng gương.
(g) Khí X có thể thu bằng cả phương pháp dời khí và dời nước.
Số phát biểu đúng là
A. 2
B. 3
C. 4
D. 5
Tiến hành thí nghiệm điều chế và thử tính chất của chất X theo các bước sau đây:
➢ Bước 1: Cho vài mẩu nhỏ canxi cacbua vào ống nghiệm đã đựng 1 ml nước và đậy nhanh bằng nút có ống dẫn khí đầu vuốt nhọn.
➢ Bước 2: Đốt khí sinh ra ở đầu ống vuốt nhọn.
➢ Bước 3: Dẫn khí qua ống nghiệm đựng dung dịch KMnO4 và dung dịch AgNO3 trong NH3
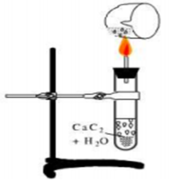
Có các phát biểu sau:
(a) Có thể thay canxi cacbua bằng đất đèn.
(b) Khí X sinh ra trong thí nghiệm còn được gọi là “khí đất đèn”, có khả năng bảo quản hoa quả tươi lâu hơn.
(c) Khi cháy, X toả nhiều nhiệt nên được dùng trong đèn xì để hàn, cắt kim loại.
(d) Dẫn khí X đến dư qua dung dịch KMnO4, màu tím nhạt dần để lại trong ống nghiệm dung dịch trong suốt, không màu.
(e) Dẫn khí X qua dung dịch AgNO3 trong NH3 thấy tạo thành kết tủa là sản phẩm của phản ứng tráng gương.
(g) Khí X có thể thu bằng cả phương pháp dời khí và dời nước.
Số phát biểu đúng là
![]()
![]()
![]()
![]()
Dẫn dòng khí CO qua ống sứ đựng CuO, nung nóng. Dẫn dòng khí \(CO_2\) qua dung dịch nước vôi trong \(Ca\left(OH\right)_2\) dư.
- Viết phương trình hóa học của hai thí nghiệm trên.
- Hai thí nghiệm đó chứng minh tính chất gì của CO và \(CO_2\).
PTHH: \(CO+CuO\underrightarrow{t^o}Cu+CO_2\)
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3\downarrow+H_2O\)
- Các thí nghiệm chứng minh:
+) CO có tính khử
+) CO2 là oxit axit
Trong phòng thí nghiệm có các lọ đựng dung dịch NaCl, H 2 S O 4 , NaOH có cùn nồng độ là 0,5M. Lấy 1 ít mỗi dung dịch trên vào ống nghiệm riêng biệt. Hỏi phải lấy như thế nào để có số mol chất tan có trong mỗi ống nghiệm là bằng nhau?
Theo công thức: n = C M .V
Muốn có số mol bằng nhau thì thể tích cũng bằng nhau
Vì C M = 0,5 mol/l. Do đó ta phải lấy thể tích các dung dịch bằng nhau vào các ống nghiệm.
Nêu hiện tượng, viết pthh xảy ra trong các thí nghiệm sau:
1. Dẫn khí CO2 vào ống nghiệm chứa nước vôi trong (Calcium hydroxide)
2. cho dung dịch sodium hydroxide NaOH vào ống nghiệm chứa dung dịch copper(II) cloride Cucl2
1)
- Ban đầu, kết tủa trắng xuất hiện, đạt đến cực đại rồi tan dần vào dd
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3\downarrow+H_2O\)
\(CaCO_3+CO_2+H_2O\rightarrow Ca\left(HCO_3\right)_2\)
2)
- Xuất hiện kết tủa xanh, màu xanh của dd nhạt dần
\(CuCl_2+2NaOH\rightarrow Cu\left(OH\right)_2\downarrow+2NaCl\)
Cho hình vẽ điều chế oxi trong phòng thí nghiệm:
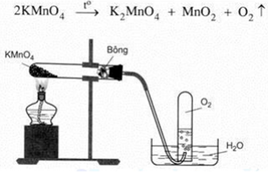
– Viết phương trình hóa học của phản ứng.
– Vì sao có thể thu khí oxi bằng phương pháp đẩy nước?
– Vì sao miệng ống nghiệm đựng KMnO4 lắp hơi nghiêng xuống?
– Nêu vai trò của bông khô?
– Khi dừng thí nghiệm nên tắt đèn cồn trước hay tháo ống dẫn khí ra trước? Tại sao?
– Dùng phương pháp đẩy nước là hợp lí vì oxi ít tan trong nước và oxi thu được có độ tinh khiết cao.
– Oxi nặng hơn không khí, khi đốt nóng KMnO4 thì áp suất tại đó cao hơn nên
– Oxi sinh ra sẽ di chuyển xuống phía dưới ống nơi áp suất thấp hơn và dễ dàng thoát ra ống dẫn khí. – Bông khô có vai trò hút ẩm.
– Khi dừng thí nghiệm nên tắt đèn cồn trước sau đó mới tháo ống dẫn khí.
Bài 1: Viết phương trình phản ứng cho mỗi thí nghiệm sau:
1. Dẫn khí CO (dư) đi qua ống sứ đựng Fe2O3 nung nóng
………………………………………………………………………………………………………………………………………………………………………………………………
2. Dẫn khí CO (dư) đi qua ống sứ đựng Al2O3 và Fe2O3 nung nóng
………………………………………………………………………………………………
………………………………………………………………………………………………
3. Dẫn khí CO2 vào dung dịch Ca(OH)2 (dư)
………………………………………………………………………………………………
………………………………………………………………………………………………
4. Dẫn khí CO2 (dư) vào dung dịch Ca(OH)2
………………………………………………………………………………………………
………………………………………………………………………………………………
5. Dẫn hỗn hợp khí CO và CO2 vào dung dịch Ba(OH)2 dư
………………………………………………………………………………………………
………………………………………………………………………………………………
\(1.\)\(Fe_2O_3+3CO\underrightarrow{^{^{t^0}}}3Fe+3CO_2\)
\(2.\)\(Fe_2O_3+3CO\underrightarrow{^{^{t^0}}}3Fe+3CO_2\)
\(3.Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3+H_2O\)
\(4.Ca\left(OH\right)_2+2CO_2\rightarrow Ca\left(HCO_3\right)_2\)
\(5.Ba\left(OH\right)_2+CO_2\rightarrow BaCO_3+H_2O\)
1) \(Fe_2O_3+3CO\underrightarrow{t^o}2Fe+3CO_2\)
2)
\(Fe_2O_3+3CO\underrightarrow{t^o}2Fe+3CO_2\)
3) \(Ca\left(OH\right)_2+CO_2->CaCO_3\downarrow+H_2O\)
4) \(Ca\left(OH\right)_2+CO_2->CaCO_3\downarrow+H_2O\)
\(CaCO_3+CO_2+H_2O->Ca\left(HCO_3\right)_2\)
5) \(Ba\left(OH\right)_2+CO_2->BaCO_3\downarrow+H_2O\)