khi hòa tan hoàn toàn a gam hỗn hợp mgco3,caco3 bằng b gam dung dịch hcl (vừa đủ) thu được c lít khí A không màu(đktc) a) xác định khí A b)tính khối lượng dung dịch muối clorua thu được theo a,b,c

Những câu hỏi liên quan
1. Hòa tan hoàn toàn m gam MgCO3 bằng dung dịch HCl vừa đủ thu được dung dịch Y và 2,688 lít khí (đktc). Cô cạn dung dịch Y thu được a gam muối khan. Biết các phản ứng xảy ra hoàn toàn. Tính giá trị của a.2. Cho m gam hỗn hợp X chứa Fe và Cu (có tỉ lệ mol 1:2) tác dụng với lượng dư dung dịch HCl thu được 3,36 lít khí H2 (đktc). Mặt khác, m gam X tác dụng vừa đủ với V lít khí Cl2 (đktc). Biết các phản ứng xảy ra hoàn toàn. Tính giá trị của V
Đọc tiếp
1. Hòa tan hoàn toàn m gam MgCO3 bằng dung dịch HCl vừa đủ thu được dung dịch Y và 2,688 lít khí (đktc). Cô cạn dung dịch Y thu được a gam muối khan. Biết các phản ứng xảy ra hoàn toàn. Tính giá trị của a.
2. Cho m gam hỗn hợp X chứa Fe và Cu (có tỉ lệ mol 1:2) tác dụng với lượng dư dung dịch HCl thu được 3,36 lít khí H2 (đktc). Mặt khác, m gam X tác dụng vừa đủ với V lít khí Cl2 (đktc). Biết các phản ứng xảy ra hoàn toàn. Tính giá trị của V
Câu 1 :\(n_{CO_2} = \dfrac{2,688}{22,4} = 0,12(mol)\)
MgCO3 + 2HCl \(\to\) MgCl2 + CO2 + H2O
..................................0,12........0,12..................(mol)
Suy ra: a = 0,12.95 = 11,4(gam)
Đúng 2
Bình luận (0)
Câu 2 :
\(Fe + 2HCl \to FeCl_2 + H_2\\ n_{Fe} = n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)\\ \Rightarrow n_{Cu} = 2n_{Fe} = 0,15.2 = 0,3(mol)\\ 2Fe+3Cl_2\xrightarrow{t^o} 2FeCl_3\\ Cu+Cl_2 \xrightarrow{t^o} CuCl_2\\ n_{Cl_2} = \dfrac{3}{2}n_{Fe} + n_{Cu} = 0,525\\ \Rightarrow V = 0,525.22,4 =11,76(lít)\)
Đúng 2
Bình luận (0)
Hòa tan hết 10 gam hỗn hợp Mg và MgCO3 trong V ml dung dịch HCl 20% (d = 1,12g/ml) vừa đủ. Sau khi phản ứng xảy ra hoàn toàn thu được 15,68 lít hỗn hợp khí A (đktc) và dung dịch B. Tỉ khối của A so với hiđro là 10.
a)Tính % khối lượng mỗi khí trong A
b)Tính m, V
c)Tính nồng độ %, nồng độ molcủa chất tan trong dung dịch B
Hòa tan hoàn toàn 10,72 gam hỗn hợp X gồm Mg, MgO, Ca, CaO bằng dung dịch HCl vừa đủ, thu được 3,284 lít khí (đktc) và dung dịch Y chứa hỗn hợp a gam CuCl2 và 12,35 gam MgCl2. Tìm giá trị của a.
nH2 = 3,248:22,4 = 0,145 mol; nMgCl2 = 12,35:5 = 0,13 mol
Đặt số mol của các chất Mg, MgO, Ca, CaO trong hỗn hợp X lần lượt là x, b, c, d (mol)
+ Khối lượng hỗn hợp là 10,72 gam nên ta có: 24x + 40b + 40c + 56d = 10,72 (1)
Phương trình hóa học:
Mg + 2HCl → MgCl2 + H2
x x x (mol)
MgO + 2HCl → MgCl2 + H2O
b b b (mol)
Ca + 2HCl → CaCl2 + H2
c c c (mol)
CaO + 2HCl → CaCl2 + H2O
d d d (mol)
+ Từ số mol H2 ta có: nH2 = x + c = 0,145 (2)
+ Từ số mol MgCl2 ta có: nMgCl2 = x + b = 0,13 (3)
Ta tổ hợp phương trình (1) + 16(2) – 40(3):
| 24x + 40b + 40c + 56d = 10,72 + 16x + 16c = 2,32 - 40x + 40b = 5,2 |
| 56c + 56d = 7,84 |
=> c + d = 0,14
=> nCaCl2 = c + d = 0,14 mol
=> a = 0,14.111 = 15,54 (gam)
Đúng 0
Bình luận (0)
Cho 22,95 gam BaO tan hoàn toàn trong nước được dung dịch A.a) Dẫn từ từ khí CO2 vào dung dịch A, thu được 23,64 gam kết tủa. Tính thể tích khí CO2 (đktc) đã phản ứng.b) Hòa tan hoàn toàn 18,4 gam hỗn hợp MgCO3 và CaCO3 trong dung dịch HCl, toàn bộ lượng khí CO2 sinh ra được hấp thụ vào dung dịch A. Hỏi có thu được kết tủa không? Tại sao?
Đọc tiếp
Cho 22,95 gam BaO tan hoàn toàn trong nước được dung dịch A.
a) Dẫn từ từ khí CO2 vào dung dịch A, thu được 23,64 gam kết tủa. Tính thể tích khí CO2 (đktc) đã phản ứng.
b) Hòa tan hoàn toàn 18,4 gam hỗn hợp MgCO3 và CaCO3 trong dung dịch HCl, toàn bộ lượng khí CO2 sinh ra được hấp thụ vào dung dịch A. Hỏi có thu được kết tủa không? Tại sao?
a) \(BaO+H_2O\rightarrow Ba\left(OH\right)_2\)
\(n_{Ba\left(OH\right)_2}=n_{BaO}=0,15\left(mol\right)\)
\(n_{BaCO_3}=\dfrac{23,64}{197}=0,12\left(mol\right)\)
Bảo toàn nguyên tố Ba => \(n_{Ba\left(HCO_3\right)_2}=0,15-0,12=0,03\left(mol\right)\)
Bảo toàn nguyên tố C: \(n_{CO_2}=0,12+0,03.2=0,18\left(mol\right)\)
=> \(V_{CO_2}=0,18.22,4=4,032\left(l\right)\)
b)Bảo toàn nguyên tố C : \(n_{CO_2}=n_{MgCO_3}+n_{CaCO_3}=a\left(mol\right)\)
Ta có : \(\dfrac{18,4}{100}< a< \dfrac{18,4}{84}\)
=> \(0,184< a< 0,22\)
\(n_{OH^-}=0,15.2=0,3\left(mol\right)\)
Lập T: \(\dfrac{0,3}{0,22}< T< \dfrac{0,3}{0,184}\)
=>\(1,36< T< 1,63\)
Do 1< \(1,36< T< 1,63\) <2
=> Phản ứng luôn tạo kết tủa
Đúng 1
Bình luận (1)
Hòa tan hoàn toàn 8 gam hỗn hợp Mg,Fe bằng dung dịch HCl 2,5M vừa đủ. Khi p/ứ kết thúc thu đc 4,48 lít khí (dktc).
a) Xác định Vdd HCl ?
b)Tính khối lượng mỗi kim loại có trong hỗn hợp trên.
PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
a, Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo PT: \(n_{HCl}=2n_{H_2}=0,4\left(mol\right)\)
\(\Rightarrow V_{ddHCl}=\dfrac{0,4}{2,5}=0,16\left(l\right)\)
b, Giả sử: \(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
⇒ 24x + 56y = 8 (1)
Theo PT: \(n_{H_2}=n_{Mg}+n_{Fe}=x+y\left(mol\right)\)
⇒ x + y = 0,2 (2)
Từ (1) và (2) ⇒ x = y = 0,1 (mol)
\(\Rightarrow\left\{{}\begin{matrix}m_{Mg}=0,1.24=2,4\left(g\right)\\m_{Fe}=5,6\left(g\right)\end{matrix}\right.\)
Bạn tham khảo nhé!
Đúng 2
Bình luận (2)
Hòa tan hoàn toàn m hỗn hợp A gồm Fe, CuO, CaCO3 cần vừa đủ m’ gam dung dịch HCl 14,6%
thu được 8,96 lit hỗn hợp khí X (đktc), dung dịch Y. Khí X có tỉ khối so với H2 bằng 6,25. Cô cạn dung
dịch Y thu được 62,7 gam chất rắn khan. Tính m, m’?
Gọi \(\left\{{}\begin{matrix}n_{H_2}=a\left(mol\right)\\n_{CO_2}=b\left(mol\right)\end{matrix}\right.\) => \(a+b=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
=> \(\overline{M}_X=\dfrac{2a+44b}{a+b}=2.6,25=12,5\left(g/mol\right)\)
=> a = 0,3; b = 0,1
PTHH: Fe + 2HCl --> FeCl2 + H2
0,3<--0,6<------0,3<---0,3
CaCO3 + 2HCl --> CaCl2 + CO2 + H2O
0,1<----0,2<------0,1<----0,1
CuO + 2HCl --> CuCl2 + H2O
x--->2x------->x
mrắn (sau pư) = 0,3.127 + 0,1.111 + 135x = 62,7
=> x = 0,1 (mol)
mA = 0,1.80 + 0,3.56 + 0,1.100 = 34,8 (g)
mHCl = (0,6 + 0,2 + 0,2).36,5 = 36,5 (g)
=> \(m'=\dfrac{36,5.100}{14,6}=250\left(g\right)\)
Đúng 4
Bình luận (0)
Hòa tan hoàn toàn m gam hỗn hợp A gồm Fe và kim loại M ( hóa trị không đổi) trong dung dịch HCl dư, thu được 1,008 lít khí (đktc) và dung dịch chứa 4,575 gam muối. 1. Tính khối lượng m. 2. Hòa tan hết m gam hỗn hợp A trong dung dịch chứa đồng thời hai axit: HNO3 ( đặc) và H2SO4 ( khi đun nóng) thu được 1,8816 lít hỗn hợp B gồm 2 khí (đktc). Tỉ khối của hỗn hợp B so với H2 bằng 25,25. Xác định kim loại M biết rằng trong dung dịch tạo thành không chứa muối amoni.
Đọc tiếp
Hòa tan hoàn toàn m gam hỗn hợp A gồm Fe và kim loại M ( hóa trị không đổi) trong dung dịch HCl dư, thu được 1,008 lít khí (đktc) và dung dịch chứa 4,575 gam muối.
1. Tính khối lượng m.
2. Hòa tan hết m gam hỗn hợp A trong dung dịch chứa đồng thời hai axit: HNO3 ( đặc) và H2SO4 ( khi đun nóng) thu được 1,8816 lít hỗn hợp B gồm 2 khí (đktc). Tỉ khối của hỗn hợp B so với H2 bằng 25,25. Xác định kim loại M biết rằng trong dung dịch tạo thành không chứa muối amoni.
Câu 1
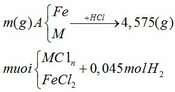
Áp dụng định luật bảo toàn nguyên
tố H ta có:
nHCl = 2nH2 = 2.0,045 = 0,09 mol
Áp dụng định luật bảo toàn khối lượng
ta có: mA + mHCl = m muối + mH2
=> m = m muối + mH2 – mA = 4,575 + 0,045.2 – 0,09.36,5 = 1,38 (gam)
Câu 2
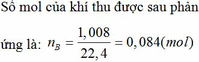
Do cho kim loại phản ứng với H2SO4 đặc và HNO3 đặc nên khí sinh ra là SO2 và NO2.
Áp dụng phương pháp đường chéo ta có:
SO2: 64 4,5
50,5
NO2: 46 13,5
→nSO2=nNO2=4,513,5=13
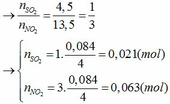
Đặt số mol của Fe và M lần lượt là x và y (mol)
- Khi cho hỗn hợp tác dụng với HCl:
Fe + 2HCl → FeCl2 + H2
x x (mol)
M + nHCl → MCln + 0,5nH2
y 0,5ny (mol)
nH2 = 0,045 => x + 0,5ny = 0,045 (1)
- Khi cho hỗn hợp tác dụng với HNO3 đặc và H2SO4 đặc:
Ta có các bán phản ứng oxi hóa – khử:
Fe → Fe3+ + 3e
x 3x
M → Mn+ + ne
y ny
S+6 + 2e → S+4 (SO2)
0,021 0,042
N+5 + 1e → N+4 (NO2)
0,063 0,063
Áp dụng định luật bảo toàn electron ta có: 3x + ny = 0,042 + 0,063 hay 3x + ny = 0,105 (2)
Từ (1) và (2) ta có hệ phương trình sau:
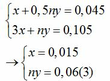
Mặt khác: mA = mFe + mM => 1,38 = 0,015.56 + My => My = 0,54(4)
Từ (3) và (4) suy ra M = 9n
Ta có bảng sau:
| n |
1 |
2 |
3 |
| M |
9 (loại) |
18 (loại) |
27 (nhận) |
Vậy kim loại M là nhôm, kí hiệu là Al.
Đúng 0
Bình luận (0)
Hoà tan hoàn toàn 1,66 gam hỗn hợp gồm Al, Fe trong 100 gam dung dịch HCl vừa đủ thu được 1,12 lít khí H2 (đktc) và dung dịch A.
a. Xác định thành phần % về khối lượng của mỗi kim loại có trong hỗn hợp đầu
b. Tính C% của dung dịch axit.
a)
Gọi : \(\left\{{}\begin{matrix}n_{Al}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\)⇒ 27a + 56b = 1,66(1)
\(2Al + 6HCl \to 2AlCl_3 + 3H_2\\ Fe +2 HCl \to FeCl_2 + H_2\)
Theo PTHH :
\(n_{H_2} = 1,5a + b = \dfrac{1,12}{22,4} = 0,05(2)\)
Từ (1)(2) suy ra a = 0,02 ; b = 0,02
Vậy :
\(\%m_{Al} = \dfrac{0,02.27}{1,66}.100\% = 32,53\%\\ \%m_{Fe} = 100\% - 32,53\% = 67,47\%\)
a)
\(n_{HCl} = 2n_{H_2} = 0,05.2 = 0,1(mol)\\ \Rightarrow C\%_{HCl} = \dfrac{0,1.36,5}{100}.100\% = 3,65\%\)
Đúng 1
Bình luận (2)
Cho m gam hỗn hợp gồm Mg và Zn hòa tan hoàn toàn trong dung dịch HCl loãng, vừa đủ thì thu được dung dịch X chứa 14,4 gam hỗn hợp muối clorua và 2,912 lít khí H2 (đktc) thoát ra. Xác định giá trị m.
$Mg + 2HCl \to MgCl_2 + H_2$
$Zn + 2HCl \to ZnCl_2 + H_2$
$n_{H_2} = \dfrac{2,912}{22,4} = 0,13(mol)$
$n_{HCl} = 2n_{H_2} = 0,13.2 = 0,26(mol)$
Bảo toàn khối lượng :
$m = m_{muối} + m_{H_2} - m_{HCl} = 14,4 + 0,13.2 - 0,26.36,5 = 5,17(gam)$
Đúng 1
Bình luận (1)
















