Cho các phương trình nhiệt hóa học:
Trong các phản ứng trên, phản ứng nào tỏa nhiệt, phản ứng nào thu nhiệt?
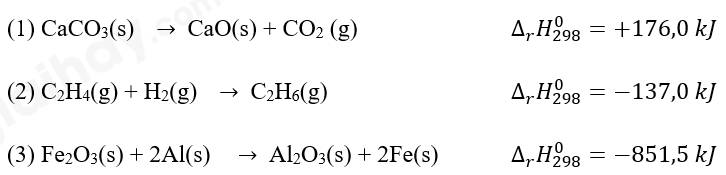
Trong các phản ứng hóa học ở thí nghiệm 2 và thí nghiệm 3, phản ứng nào tỏa nhiệt, phản ứng nào thu nhiệt?

Thí nghiệm 2: Thu nhiệt
Thí nghiệm 3: Toả nhiệt
Phản ứng tỏa nhiệt là thí nghiệm 2, phản ứng thu nhiệt là thí nghiệm 3
1. a) Hãy viết phương trình hóa học của các phản ứng giữa hiđro với hỗn hợp đồng (II) oxit và sắt (III) oxit ở nhiệt độ thích hợp?.
b) Trong các phản ứng hóa học trên, chất nào là chất khử, chất nào là chất oxi hóa? Vì sao?
c) Nếu thu được 6,00 gam hỗn hợp hai kim loại, trong đó có 2,8g sắt thì thể tích (ở đktc) khí hiđro vừa đủ cần dùng để khử đồng (II) oxit và sắt (III) oxit là bao nhiêu?
2.Cho các kim loại kẽm, nhôm, sắt lần lượt tác dụng với dung dịch axit sunfuric loãng.
a) Viết các phương trình phản ứng.
b) Cho cùng một khối lượng các kim loại trên tác dụng hết với axit sunfuric? Kim loại nào cho nhiều khi hiđro nhất?
c) Nếu thu được cùng một thể tích khí hiđro thì khối lượng kim loại nào nhỏ nhất?
CuO+H2-t0-> Cu +H2O
Fe2O3+3H2-t0->2Fe+3H2O
chất khử là H2
chất oxi hóa là CuO và Fe2O3. vì chất khử là chất chiếm oxi của chất khác, còn chất oxi hóa là chất nhường oxi cho chất khác
theo đề bài ->mFe=2,8 g->nFe=0,05 mol
=>mCu=6-2,8=3,2 g->nCu=0,05mol
theo PTPỨ =>nCu=nH2=0,05 mol
3nH2=2nFe->nH2=(2/3)*0,05=1/30 mol
do đó VH2 phản ứng là: (0,05+1/30)*22,4=1,867 lít
câu 2
a)Zn+H2SO4->ZnSO4+H2
2Al+3H2SO4->Al2(SO4)3+3H2
Fe+H2SO4->FeSO4+H2
b) Fe
cậu chỉ cần đặt a là số gam của từng kim loai.(vì khối lượng của mỗi kim loại bằng nhau). Sau đó theo phương trình cậu tính khối lượng khí H2 ở mỗi phương trình rồi so sánh là được
c) Fe cách tính gần giống phần b nên tự logic nha
Khử 0,15 mol Fe2O3 ở nhiệt độ cao bằng những chất khác nhau là khí CO, khí H2, bột Al
a. Viết Phương trình phản ứng hóa học xảy ra
b. Các phản ứng hóa học trên thuộc loại phản ứng nào? Cho biết vai trò của mỗi chất tham gia ở các
phản ứng trên
c. Tính thể tích (đktc) của chất khử thể khí và khối lượng của chất khử thể rắn đã dùng.
d. Khối lượng sắt thu được sau các phản ứng trên có khác nhau không? Giải thích
a)
$Fe_2O_3 + 3CO \xrightarrow{t^o} 2Fe + 3CO_2$
$Fe_2O_3 + 3H_2 \xrightarrow{t^o} 2Fe + 3H_2O$
$Fe_2O_3 + 2Al \xrightarrow{t^o} 2Fe + Al_2O_3$
b) Phản ứng oxi hóa - khử
Chất khử : $CO,H_2,Al$
Chấy oxi hóa : $Fe_2O_3$
c)
$n_{CO} = n_{H_2} = 3n_{Fe_2O_3} = 0,45(mol)$
$V_{CO} = V_{H_2} = 0,45.22,4 = 10,08(lít)$
$n_{Al} = 2n_{Fe_2O_3} = 0,3(mol)$
$m_{Al} = 0,3.27 = 8,1(gam)$
d)
Khối lượng sắt thu được ở phản ứng trên đều như nhau
(Do đều sinh ra Fe với tỉ lệ mol $Fe_2O_3$ : $Fe$ là 1 : 2)
Điều nào sau đây không đúng cho phản ứng của khí CO và O2?
A. Phản ứng thu nhiệt.
B. Phản ứng tỏa nhiệt.
C. Phản ứng kèm theo sự giảm thể tích.
D. Phản ứng không xảy ra ở điều kiện thường.
Liệt kê tối thiểu 5 ví dụ về :
a. Phản ứng tỏa nhiệt
b. Phản ứng thu nhiệt
c. Quá trình thu nhiệt
Biến thiên entanpi của phản ứng (kí hiệu là \(\Delta H\)) có thể hiểu đơn giản là nhiệt tỏa ra hoặc thu vào khi phản ứng hóa học xảy ra. Nếu phản ứng tỏa nhiệt thì \(\Delta H\) có dấu âm và ngược lại, nếu phản ứng thu nhiệt thì \(\Delta H\) có dấu dương. Khi một phản ứng hóa học xảy ra, các liên kết trong chất phản ứng bị cắt đứt và các liên kết mới được hình thành, tạo nên chất sản phẩm. Để tính \(\Delta H\) của phản ứng, người ta dựa vào năng lượng các liên kết \(\left(E_{lk}\right)\). \(E_{lk}\) là năng lượng cần cung cấp để cắt đứt một liên kết thành các nguyên tử ở thể khí. Năng lượng tỏa ra khi hình thành liên kết đó từ các nguyên tử ở thể khí cũng có giá trị bằng giá trị của \(E_{lk}\) nhưng có dấu ngược lại.
\(E_{lk}\) của một số liên kết được cho trong bảng sau:
| Liên kết | C\(\equiv\)C\(\) | C-C | C-H | H-H |
| \(E_{lk}\left(kJ/mol\right)\) | 839,0 | 343,3 | 418,4 | 432,0 |
Xét phản ứng: \(C_2H_2+2H_2\rightarrow C_2H_6\left(1\right)\)
Dựa vào bảng số liệu trên hãy:
a. Tính năng lượng cần cung cấp để phá vỡ liên kết của các chất tham gia trong phản ứng (1) (Lưu ý hệ số của các chất trong phương trình phản ứng).
b. Tính năng lượng tỏa ra khi hình thành các liên kết trong chất sản phẩm của phản ứng (1)
c. Từ các kết quả trên, xác định \(\Delta H\) của phản ứng (1) và cho biết phản ứng (1) tỏa nhiệt hay thu nhiệt.
\(a.E_r=839,0+2\cdot418,4+2\cdot432,0=2539,8kJ\\ b.E_p=343,3+6\cdot418,4=2853,7kJ\\ c.\Delta_rH^{^{ }0}=2539,8-3197=-313,9kJ\cdot mol^{-1}\\ \Delta H< 0:pư.thu.nhiệt\)
\(a.E_{reactants}=839,0+2\cdot432,0=1703kJ\\ b.E_{products}=343,3+6\cdot432,0=2935,3kJ\\ c.\Delta_rH^{^o}_{298}=E_r-E_p=1703-2935,3=1232,3kJ\cdot mol^{^{ }-1}.\)
\(\Delta H< 0\) => Phản ứng (1) thu nhiệt
Có các phát biểu về cân bằng hóa học:
1. Cân bằng hóa học là một cân bằng bền.
2. Nếu phản ứng thuận tỏa nhiệt ( ∆ H < 0 ) thì khi tăng nhiệt độ cân bằng sẽ bị chuyển dịch về phía trái (phản ứng nghịch).
3. Nếu phản ứng thuận tỏa nhiệt thì phản ứng nghịch thu nhiệt.
4. Nếu trong phản ứng mà số mol khí tham gia bằng số mol khí tạo thành thì áp suất không ảnh hưởng tới cân bằng hóa học.
5. Hằng số cân bằng bị thay đổi khi nồng độ các chất thay đổi.
6. Trong biểu thức về hằng số cân bằng có mặt nồng độ của tất cả các chất tham gia phản ứng.
Hãy chọn các phát biểu sai.
A. 1 và 5
B. 1 và 6
C. 1 , 5, 6
D. 1 , 3 , 5 ,6.
Đáp án C
1. Sai: cân bằng hóa học là cân bằng động
2. đúng: phản ứng nghịch thu nhiệt, khi tăng nhiệt độ cân bằng sẽ chuyển về phía làm giảm nhiệt độ (thu nhiệt).
3. đúng
4. đúng
5. sai, nồng độ thay đổi không làm thay đổi hằng số cân bằng. Hằng số cân bằng chỉ thay đổi khi thay đổi nhiệt độ.
6. sai: chỉ tính những chất khí hoặc những chất tan trong dung dịch, nếu là chất rắn thì không được tính.
=> Đáp án C
Có các phát biểu về cân bằng hóa học:
1. Cân bằng hóa học là một cân bằng bền.
2. Nếu phản ứng thuận tỏa nhiệt ( △ H < 0 ) thì khi tăng nhiệt độ cân bằng sẽ bị chuyển dịch về phía trái (phản ứng nghịch).
3. Nếu phản ứng thuận tỏa nhiệt thì phản ứng nghịch thu nhiệt.
4. Nếu trong phản ứng mà số mol khí tham gia bằng số mol khí tạo thành thì áp suất không ảnh
hưởng tới cân bằng hóa học.
5. Hằng số cân bằng bị thay đổi khi nồng độ các chất thay đổi.
6. Trong biểu thức về hằng số cân bằng có mặt nồng độ của tất cả các chất tham gia phản ứng.
Hãy chọn các phát biểu sai.
A. 1 và 5
B. 1 và 6
C. 1, 5, 6
D. 1, 3, 5, 6
1. sai: cân bằng hóa học là cân bằng động
2. đúng: phản ứng nghịch thu nhiệt, khi tăng nhiệt độ cân bằng sẽ chuyển về phía làm giảm nhiệt độ (thu nhiệt).
3. đúng
4. đúng
5. sai, nồng độ thay đổi không làm thay đổi hằng số cân bằng. Hằng số cân bằng chỉ thay đổi khi thay đổi nhiệt độ.
6. sai: chỉ tính những chất khí hoặc những chất tan trong dung dịch, nếu là chất rắn thì không được tính.
Đáp án C
Viết phương trình hóa học biểu diễn phản ứng của hiđro với các chất: O2, Fe2O3, Fe3O4, PbO ở nhiệt độ thích hợp. Ghi rõ điều kiện phản ứng. Giải thích và cho biết mỗi phản ứng trên thuộc loại phản ứng gì?
Phương trình hóa học biểu diễn các phản ứng:
2H2 + O2  2H2O (pứ hóa hợp + oxi hóa khử)
2H2O (pứ hóa hợp + oxi hóa khử)
4H2 + Fe3O4  4H2O + 3Fe (pứ thế + oxi hóa khử)
4H2O + 3Fe (pứ thế + oxi hóa khử)
3H2 + Fe2O3  3H2O + 3Fe (pứ thế + oxi hóa khử)
3H2O + 3Fe (pứ thế + oxi hóa khử)
H2 + PbO 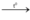 H2O + Pb (pứ thế + oxi hóa khử)
H2O + Pb (pứ thế + oxi hóa khử)
Các phản ứng trên đều là phản ứng oxi – hóa khử vì đều có đồng thời sự khử và sự oxi hóa
Viết phương trình hóa học biểu diễn phản ứng của hiđro với các chất: O2, Fe2O3, Fe3O4, PbO ở nhiệt độ thích hợp. Ghi rõ điều kiện phản ứng. Giải thích và cho biết mỗi phản ứng trên thuộc loại phản ứng gì?
\(2H_2+O_2\xrightarrow[]{t^o}2H_2O\\ Fe_2O_3+3H_2\xrightarrow[]{t^o}2Fe+3H_2O\\ Fe_3O_4+4H_2\xrightarrow[]{t^o}3Fe+4H_2O\\ PbO+H_2\xrightarrow[]{t^o}Pb+H_2O\)