Biểu diễn cấu hình electron của các nguyên tử có Z = 8 và Z = 11 theo ô orbital.

Những câu hỏi liên quan
Biểu diễn cấu hình theo ô orbital (chỉ với lớp ngoài cùng) các nguyên tử có Z từ 1 đến 20. Xác định số electron độc thân của mỗi nguyên tử.
Số hiệu nguyên tử Z | Orbital | Số electron độc thân |
1 | 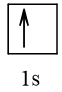 | 1 |
2 | 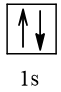 | 0 |
3 | 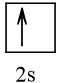 | 1 |
4 | 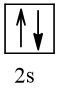 | 0 |
5 | 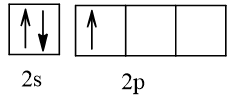 | 1 |
6 | 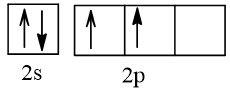 | 2 |
7 | 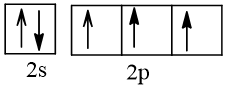 | 3 |
8 | 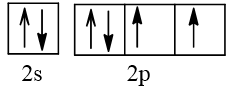 | 2 |
9 | 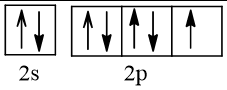 | 1 |
10 | 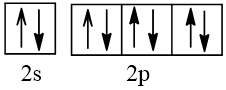 | 0 |
11 | 1 | |
12 | 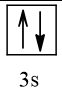 | 0 |
13 | 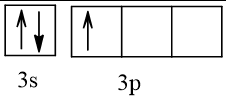 | 1 |
14 | 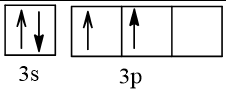 | 2 |
15 | 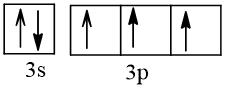 | 3 |
16 | 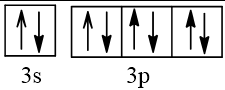 | 2 |
17 | 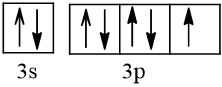 | 1 |
18 | 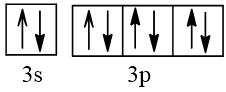 | 0 |
19 | 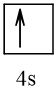 | 1 |
20 | 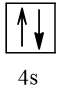 | 0 |
Đúng 0
Bình luận (0)
4.13Cho các nguyên tố có diện tích hạt nhân như sau Z=7;Z=14 và Z=21. biểu diễn cấu hình electron của nguyên tử theo ô orbital. Tại sao lại phân bố như vậy ?
4.14Cho các nguyên tố có diện tích hạt nhân như sau:Z=9;Z=16;Z=18;Z=20 và Z=29
Cho ngtử K(Z=19) a) viết cấu hình electron nguyên tử và biểu diễn cấu hình theo ô orbital của nguyên tử Cl b)hãy cho biết Cl là nguyên tố s,p hay d?giải thích
Câu1:biễu diễn cấu hình của oxygen và potassium trong ô orbital. xác định số electron độc thân Câu 2: nêu các quy tắc dự đoán tính chất dựa vào cấu hình electron. Câu3: dự đoán tính chất hóa học cơ bản (tính kim loại, phi kim) của 20 nguyên tố có z từ 1 đến 20
Viết cấu hình electron nguyên tử của nguyên tố aluminium (Z = 13) và biểu diễn cấu hình electron của aluminium theo ô orbital. Từ đó, xác định số electron độc thân của nguyên tử này.
- Nguyên tử có Z = 13 => Có 13 electron
- Viết theo thứ tự: 1s 2s 2p 3s 3p 4s 3d… (trong đó phân lớp s chứa tối ta 2 electron, phân lớp p chứa tối đa 6 electron, phân lớp d chứa tối đa 10 electron, phân lớp f chứa tối đa 14 electron)
- Điền các electron: 1s22s22p63s23p1
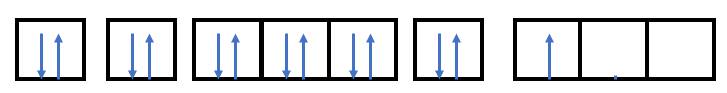
=> Nguyên tử aluminium có 1 electron độc thân
Đúng 1
Bình luận (0)
Z: 1s22s22p33s23p1
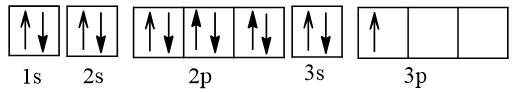
=> Số e độc thân: 1
Đúng 0
Bình luận (0)
Cho nguyên tử của các nguyên tố: X (Z 11); Y (Z 12); L (Z 17); E (Z 16); G (Z 8); Q (Z 9); T (Z 18); M (Z 19). Trường hợp nào sau đây chỉ gồm các nguyên tử và ion có cùng cấu hình electron? A. X+ , Y2+ , G2- , L- B. L- , E2+ , T , M+ C. X+ , Y2+ , G2- ,Q D. Q-, E2+ , T , M+
Đọc tiếp
Cho nguyên tử của các nguyên tố: X (Z = 11); Y (Z = 12); L (Z = 17); E (Z = 16); G (Z = 8); Q (Z = 9); T (Z = 18); M (Z = 19). Trường hợp nào sau đây chỉ gồm các nguyên tử và ion có cùng cấu hình electron?
A. X+ , Y2+ , G2- , L-
B. L- , E2+ , T , M+
C. X+ , Y2+ , G2- ,Q
D. Q-, E2+ , T , M+
Chọn đáp án B.
Dễ dàng nhìn thấy L- , E2- , T, M+ đều có cùng cấu hình electron của khí hiếm Ar.
Đúng 0
Bình luận (0)
Viết cấu hình electron của các nguyên tử sau Z=3 Z=8 Z=11 Z=17 Z=20 Z=35
Cho các nguyên tố li ti z = 3 oxy z = 8 F z = 9 và natri z = 11 A viết cấu hình electron và xác định vị trí các nguyên tố trên trong bảng tuần hoàn B sắp xếp các nguyên tố trên theo chiều tăng dần bán kính nguyên tử và
Cấu hình electron của các nguyên tử có số hiệu Z3, Z11, Z19 có đặc điểm chung là A. có 4 electron lớp ngoài cùng. B. có 3 electron ở lớp ngoài cùng. C. có 2 electron ở lớp ngoài cùng. D. có 1 electron ở lớp ngoài cùng.
Đọc tiếp
Cấu hình electron của các nguyên tử có số hiệu Z=3, Z=11, Z=19 có đặc điểm chung là
A. có 4 electron lớp ngoài cùng.
B. có 3 electron ở lớp ngoài cùng.
C. có 2 electron ở lớp ngoài cùng.
D. có 1 electron ở lớp ngoài cùng.















