Đốt cháy hoàn toàn 26g bột đồng có lẫn tạp chất không cháy cần dùng 6,4g khí O2 thu được 32gam sản phẩm ( biết Cu trong sản phẩm hóa trị 2). Tính thành phần phần trăm về khối lượng của tạp chất trong lượng bột đồng trên.
Đốt cháy hoàn toàn 20g bột Fe và S phải dùng hết 6,72l khí Oxi (đktc)
a)tính thành phần phần trăm về khối lượng của mỗi chất
b)tính khối lượng của mỗi sản phẩm thu được
\(Đặt:n_{Fe}=a\left(mol\right);n_S=b\left(mol\right)\left(a,b>0\right)\\ 3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\\ S+O_2\rightarrow\left(t^o\right)SO_2\\ \Rightarrow\left\{{}\begin{matrix}56a+32b=20\\\dfrac{44,8}{3}a+22,4b=6,72\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,3\\b=0,1\end{matrix}\right.\\ a,\%m_{Fe}=\dfrac{0,3.56}{20}.100\%=84\%\\ \%m_S=100\%-84\%=16\%\\ b,m_{sp}=m_{hhFe,S}+m_{O_2}=20+0,3.32=29,6\left(g\right)\)
a) \(n_{O_2}=\dfrac{6,72}{22,4}=0,3\) (mol)
Gọi x,y lần lượt là số mol của Fe và S.(x,y>0)
Theo bài ra, ta có: 56x+32y=20 (I)
PTHH: \(3Fe\) + \(2O_2\)\(\underrightarrow{t^o}\)\(Fe_3O_4\).
Theo pt: x\(\rightarrow\) \(\dfrac{2}{3}x\) \(\dfrac{1}{3}x\) (mol) (1)
PTHH: \(S+O_2\) \(\underrightarrow{t^o}\) \(SO_2\).
Theo pt: y \(\rightarrow\) y y (mol) (2)
Từ (1) và (2) \(\Rightarrow\) \(\sum n_{O_2}=\dfrac{2}{3}x+y=0,3\) (mol) (II)
Giải hệ phương trình (I) và (II) ta được \(\left\{{}\begin{matrix}x=0,3\\y=0,1\end{matrix}\right.\)
\(\Rightarrow\) \(m_{Fe}=0,3.56=16,8\left(g\right)\)
\(\Rightarrow\%m_{Fe}=\dfrac{16,8}{20}.100\%=84\%\)
\(\Rightarrow\%m_S=100\%-84\%=16\%\)
b) \(m_{Fe_3O_4}=0,1.\left(3.56+4.16\right)=23,2\left(g\right)\)
\(m_{SO_2}=0,1.\left(32+2.16\right)=6,4\left(g\right)\)
1)cho 4.48 lít khí metan và etilen ở dktc đốt cháy hoàn toàn ; sản phẩm cháy cho lội qua bình đựng nước vôi trong dư thấy tạo thành 70 g chất rắn .tính thành phần phần trăm về khối lượng và thành phần phần trăm về thể tích mỗi khí trong hỗn hợp tạp chất ban đầu
2) đốt cháy hoàn toàn 4.48 lít hỗn hợp khí metan và butilen ; sản phẩm cháy cho lội qua bình đựng nước vôi trong dư thấy tạo thành 130g chất rắn
a, hỏi cần đốt cháy hết lượng butilen nói trên thì thể tích khí O2 ở ddktc là bao nhiêu
b, nếu đem lượng butilen ở trên lội qua bình đựng 2 lít dung dịch nước brom 0.5M sau phản ứng .tính nồng độ mol/lít dung dịch cho rằng thể tích dung dịch ko thay đổi và butilenbromua tan được trong nước
1) nh2=0,2; n CACO3=0,7
pt1: CH4+2O2 ---> CO2+2H2O
x x
pt2: C2H4 +3O2 ----> 2CO2+2H2O
y 2y
pt3: CO2+CA(OH)2 ----> CACO3+H2O
0,7 0,7
ta có hệ pt: x+y=0,2
x+2y=0,7
tự tìm
b) nbr2=1
pt: C4H6+ 2Br2 -----> C4H6Br4
0,05 0,1 0,05
tỉ lệ: 0,3/1 > 0,1/2 => C4H6 dư
CM C4H6Br2=0,05/8,72
CM C4H6 dư= 0,25/8,72
A)nh2=8,96/22,4=0,4; nCaCO3=130/100=1,3
pt ở dưới nhé =>nCO2=1,3
ta có hệ pt: x+2y=0,4
x+8y=1,3
=> x=0,1; y=0,15
=>VC4H6=0,3.22,4=6,72 (L)
=>VO2=1,85.22,4=41,44 (L)
đốt cháy hoàn toàn 9,6 tấn than trong đó C chiếm 80% về khối lượng của than,phần còn lại là tạp chất. a,Tính mC và m tạp chất có trong than b,lập PTHH biết sản phẩm cháy là CO2 c,tính mCO2 thu được
hộ với ạ
\(a,m_{C}=9,8.80\%=7,68(tấn)\\ m_{\text{tạp chất}}=9,6-7,68=1,92(tấn)\\ b,PTHH:C+O_2\xrightarrow{t^o}CO_2\\ c,n_{C}=\dfrac{7680}{12}=640(kmol)\\ \Rightarrow n_{CO_2}=640(kmol)\\ \Rightarrow m_{CO_2}=640.44=28160(kg)=28,16(tấn)\)
Đốt cháy hoàn toàn a gam hỗn hợp rươuj êtylic và axit axêtic, thì cần dùng 11,2 lít khí O2 (đktc). Dẫn toàn bộ sản phẩm cháy đi qua dung dịch nước vôi trong dư thì thu được 40g kết tủa.
a) Tìm a.
b) Tính thành phần % theo khối lượng của mỗi chất trong hỗn hợp
c) Nếu cho a gam hỗn hợp trên phản ứng với dung dịch Natri Cacbonat dư thì thu được V lít khí B thoát ra ở đktc. Vậy khí B là khí gì? Tìm V.
a)
Gọi số mol C2H5OH, CH3COOH là a, b (mol)
\(n_{O_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\); \(n_{CaCO_3}=\dfrac{40}{100}=0,4\left(mol\right)\)
PTHH: C2H5OH + 3O2 --to--> 2CO2 + 3H2O
a----->3a-------->2a
CH3COOH + 2O2 --to--> 2CO2 + 2H2O
b------>2b-------->2b
Ca(OH)2 + CO2 --> CaCO3 + H2O
0,4<----0,4
=> \(\left\{{}\begin{matrix}3a+2b=0,5\\2a+2b=0,4\end{matrix}\right.\) => a = 0,1 (mol); b = 0,1 (mol)
a = 0,1.46 + 0,1.60 = 10,6 (g)
b) \(\left\{{}\begin{matrix}\%m_{C_2H_5OH}=\dfrac{0,1.46}{10,6}.100\%=43,4\%\\\%m_{CH_3COOH}=\dfrac{0,1.60}{10,6}.100\%=56,6\%\end{matrix}\right.\)
c)
PTHH: 2CH3COOH + Na2CO3 --> 2CH3COONa + CO2 + H2O
0,1----------------------------------->0,05
B là khí CO2
V = 0,05.22,4 = 1,12 (l)
đốt cháy hoàn toàn lượng bột nhôm (Al) cần dùng 7,437L khí oxygen (O2) ở điều kiện chuẩn
a) Lập PTHH của phản ứng trên
b) tính khối lượng chất sản phẩm thu được
c) nếu giả sử trong phản ứng chỉ thu được 18,36 g sản phẩm thì hiệu suất phản ứng trên là bao nhiêu
a, \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
b, \(n_{O_2}=\dfrac{7,437}{24,79}=0,3\left(mol\right)\)
Theo PT: \(n_{Al_2O_3}=\dfrac{2}{3}n_{O_2}=0,2\left(mol\right)\)
\(\Rightarrow m_{Al_2O_3}=0,2.102=20,4\left(g\right)\)
c, \(H=\dfrac{18,36}{20,4}.100\%=90\%\)
Đốt hoàn toàn 120 gam than đá( lẫn tạp chất không cháy). sau phản ứng thu được 264 gam CO2. tìm tỉ lệ phần trăm khối lượng tạp chất trong than đá
PTHH: \(C+O_2\xrightarrow[]{t^o}CO_2\)
Tính theo sản phẩm
Ta có: \(n_C=n_{CO_2}=\dfrac{264}{44}=6\left(mol\right)\)
\(\Rightarrow\%m_C=\dfrac{12\cdot6}{120}\cdot100\%=60\%\) \(\Rightarrow\%_{tạp.chất}=40\%\)
\(n_{CO_2}=\frac{264}{44}=6(mol)\\ C+O_2\buildrel{{t^o}}\over\longrightarrow CO_2\\ n_{C}=n_{CO_2}=6(mol)\\ m_{C}=6.12=72(g)\\ \%m_{\text{tạp chât}}=\frac{120-72}{120}.100\%=40\%\)
Để đốt cháy hoàn toàn 2,50 g chất A phải dùng vừa hết 3,36 lít O 2 (đktc). Sản phẩm cháy chỉ có C O 2 và H 2 O , trong đó khối lượng C O 2 hơn khối lượng H 2 O là 3,70 g. Tính phần trăm khối lượng của từng nguyên tố trong chất A.
Khi A tác dụng với O 2 chỉ sinh ra, và H 2 O , vậy A có chứa cacbon, hiđro, có thể có hoặc không có oxi.
Theo định luật bảo toàn khối lượng :
m C O 2 + m H 2 O = m A + m O 2 = 7,30 (g) (1)
Theo đầu bài: m C O 2 + m H 2 O = 3,70(g). (2)
Từ hệ (1) và (2), tìm được m C O 2 = 5,50 g; m H 2 O = 1,80 g.
Khối lượng C trong 5,50 g
C
O
2
: 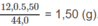
Khối lượng H trong 1,8 g
H
2
: 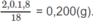
Đó cũng là khối lượng c và H trong 2,50 g chất A. Vậy chất A phải chứa O.
Khối lượng O trong 2,50 g A: 2,50 - 1,50 - 0,200 = 0,80 (g)
Phần trăm khối lượng của C: 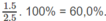
Phần trăm khối lương của H: 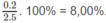
Phần trăm khối lương của O: 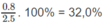
giúp em câu này với ạ,em cân gấp.Em cảm ơn
Đốt cháy hoàn toàn 27 gam nhôm có lẫn tạp chất không cháy được sau phản ứng được 40,8 g Al2O3
a. tính thể tích oxi cần dùng ở điều kiện tiêu chuẩn ?
b. tính phần trăm khối lượng tạp chất có trong than?
a. \(n_{Al}=\dfrac{27}{27}=1\left(mol\right)\)
\(n_{Al_2O_3}=\dfrac{40.8}{102}=0,4\left(mol\right)\)
PTHH : 4Al + 3O2 -----to---> 2Al2O3
0,8 0,6 0,4
Xét tỉ lệ : 1 > 0,4 => Al dư , Al2O3 đủ
\(m_{Al}=0,8.27=21,6\left(g\right)\)
b. \(m_{tạp.chất}=27-21,6=5,4\left(g\right)\)
\(\%_{tạp.chất}=\dfrac{5.4}{27}.100\%=20\%\)
Đốt cháy hoàn toàn 7,5g than đá (biết than đá có thành phần chính là C, chứa 4% tạp chất không cháy) thu được CO2. Thể tích O2 cần dùng (đkc) để đốt cháy hết lượng than đá trên là?
Ta có: mC = 7,5.(100 - 4)% = 7,2 (g)
\(\Rightarrow n_C=\dfrac{7,2}{12}=0,6\left(mol\right)\)
PT: \(C+O_2\underrightarrow{t^o}CO_2\)
Theo PT: \(n_{O_2}=n_C=0,6\left(mol\right)\Rightarrow V_{O_2}=0,6.24,79=14,874\left(l\right)\)