Lập công thức gồm 40o, 6,67%h còn lại là oxi. biét tỉ khói hc so với h là 30

Những câu hỏi liên quan
Đạm Ure có thành phần các nguyên tố : 46,47% N , 6,67% H , 20% C , còn lại là Oxi . Xác định công thức đơn giản
Hợp chât hữu cơ X có phần trăm khối lượng của C,H lần lượt bằng 40%;6,67%,còn lại là oxi. Tỉ khối hơi của X so với He bằng 15. CTPT của X là (Cho He=4)
$\%O = 100\% - 40\% - 6,67\% = 53,33\%$
$M_X = 15.4 = 60(đvC)$
Gọi CTPT của X là $C_xH_yO_z$
Ta có :
$\dfrac{12x}{40} = \dfrac{y}{6,67} = \dfrac{16z}{53,33} = \dfrac{60}{100}$
Suy ra : x = 2; y = 4 ; z = 2
Vậy CTPT của X là $C_2H_4O_2$
Đúng 1
Bình luận (0)
Kết quả phân tích nguyên tố hợp chất X Cho biết %C = 40,00% ; %H = 6,67% còn lại là oxy. Lập công thức đơn giản nhất của X
Gọi ct chung: \(C_xH_yO_z\)
\(\%O=100\%-40\%-6,67\%=53,33\%\)
Lập tỉ lệ ta có:
\(C=40\div12=3,3...\) làm tròn lên là 3.
\(H=6,67\div1=6,67\) làm tròn lên là 7.
\(O=53,33\div16=3,3...\) làm tròn lên là 3.
\(\Rightarrow CTHH:C_3H_7O_3\)
Đúng 5
Bình luận (0)
Câu 16: Hoàn thành sơ đồ chuyển hóa, ghi rõ điều kiện (nếu có):NH3 -- N2 -- NO -- NO2 -- HNO3-- Mg(NO3)2Câu 17: Một hợp chất hữu cơ X có phần trăm khối lượng %C 40%, %H 6,67%, còn lại là oxi.1. Lập công thức đơn giản nhất của X2. Tìm công thức phân tử của X. Biết tỉ khối hơi của X so với nitơ xấp xỉ bằng 2,143.Câu 18: Đốt cháy hoàn toàn 17,6 gam một hợp chất hữu cơ A thu được 17,92 lít CO2 (đktc) và 14,4 gam nước.a. Xác định công thức đơn giản nhất của A.b. Lập công thức phân tử của A. Biết ...
Đọc tiếp
Câu 16: Hoàn thành sơ đồ chuyển hóa, ghi rõ điều kiện (nếu có):
NH3 --> N2 --> NO --> NO2 --> HNO3--> Mg(NO3)2
Câu 17: Một hợp chất hữu cơ X có phần trăm khối lượng %C = 40%, %H = 6,67%, còn lại là oxi.
1. Lập công thức đơn giản nhất của X
2. Tìm công thức phân tử của X. Biết tỉ khối hơi của X so với nitơ xấp xỉ bằng 2,143.
Câu 18: Đốt cháy hoàn toàn 17,6 gam một hợp chất hữu cơ A thu được 17,92 lít CO2 (đktc) và 14,4 gam nước.
a. Xác định công thức đơn giản nhất của A.
b. Lập công thức phân tử của A. Biết tỉ khối hơi của A so với không khí là 3,035.
Câu 17:
\(1.\) Đặt CTHH là \(C_xH_yO_z\)
\(\%_O=100\%-40\%-6,67\%=53,33\%\\ \Rightarrow x:y:z=\dfrac{40}{12}:\dfrac{6,67}{1}:\dfrac{53,33}{16}=3,33:6,67:3,33=1:2:1\\ \Rightarrow CTDGN:\left(CH_2O\right)_n\)
\(2.\) Ta có \(M_{\left(CH_2O\right)_n}=2,143\cdot14\cdot2=60=30n\)
\(\Rightarrow n=2\)
Vậy \(CTHH_X:C_2H_4O_2\)
Đúng 4
Bình luận (0)
Câu 16:
\((1)2NH_3\xrightarrow{t^o,xt}3H_2+N_2\\ (2)N_2+O_2\buildrel{{t^o}}\over\rightleftharpoons2NO\\ (3)2NO+O_2\to 2NO_2\\ (4)4NO_2+O_2+2H_2O\to 4HNO_3\\ (5)10HNO_3+4Mg\to 4Mg(NO_3)_2+N_2O\uparrow +5H_2O\)
Đúng 4
Bình luận (0)
Câu 18:
a) \(n_{CO_2}=\dfrac{17,92}{22,4}=0,8\left(mol\right)\); \(n_{H_2O}=\dfrac{14,4}{18}=0,8\left(mol\right)\)
Bảo toàn C: nC(A) = 0,8 (mol)
Bảo toàn H: nH(A) = 0,8.2 = 1,6 (mol)
=> \(n_O=\dfrac{17,6-0,8.12-1,6}{16}=0,4\left(mol\right)\)
=> nC : nH : nO = 0,8 : 1,6 : 0,4 = 2 : 4 : 1
=> CTDGN: C2H4O
b) MA = 3,035.29 = 88 (g/mol)
=> CTHH: C4H8O2
Đúng 2
Bình luận (0)
Tỉ khối A so với không khí là 2,069. Trong A có 40%C, 6,67%H, 53,33%O. Xác định công thức phân tử của A. A.C3H6O B. C3H8O C. C2H4O2 D. C4H10O
Đọc tiếp
Tỉ khối A so với không khí là 2,069. Trong A có 40%C, 6,67%H, 53,33%O. Xác định công thức phân tử của A.
A.C3H6O
B. C3H8O
C. C2H4O2
D. C4H10O
Đáp án C
MA =29.2,069 = 60
Gọi công thức phân tử của A là CxHyOz thì:
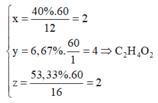
Đúng 0
Bình luận (0)
Chất X chứa 40% cacbon, 6,67 hidro và 53,33% oxi. Tỉ khối hô so với hidro là 30. Tìm công thức phân tử của X
Khí X có tỉ khối so với không khí là 0,552 gồm 2 nguyên tố trong đó có75%C còn lại là H hãy xác định công thức hóa học của x
MX = 0,552.29 = 16 (g/mol)
\(m_C=\dfrac{16.75}{100}=12\left(g\right)=>n_C=\dfrac{12}{12}=1\left(mol\right)\)
\(m_H=16-12=4\left(g\right)=>n_H=\dfrac{4}{1}=4\left(mol\right)\)
=> CTHH: CH4
Đúng 1
Bình luận (0)
Lập CTHH của hợp chất Y biết hợp chất chứa 40% C;6,67%H;còn lại là O và tỉ khối hơi của Y đối với kí N2 trong khoảng từ 2 tới 3
Lập CT hóa học của các hợp chất sau
1)Hợp chất A chứa 40% C;6,67%H;còn lại là O.biết MA=60g/mol
2)Hợp chất B chứa 81,82%C;còn lại là H .biết tỉ khối của B đối với CO2 bằng 1
3)Hớp chất D chứa 70%Fe;còn lại là O
gấp gấp giúp mình với
Trong phân tử hợp chất hữu cơ X có %C = 74,16% ; %H = 7,86%, còn lại là oxi. Tỉ khối hơi của X so với hiđro bằng 89. X có công thức phân tử là:
A. C10H10O3. B. C13H6O. C. C12H18O. D. C11H14O2.
\(d_{\dfrac{X}{H_2}}=89\\ M_{H_2}=2\left(\dfrac{g}{mol}\right)\\ \Rightarrow M_X=d_{\dfrac{X}{H_2}}.M_{H_2}=89.2=178\left(\dfrac{g}{mol}\right)\)
\(m_C=\%C.M_X=74,16\%.178=132\left(g\right)\\ m_H=\%H.M_X=7,86\%.178=14\left(g\right)\\ m_O=m_X-m_C-m_H=178-132-14=32\left(g\right)\\\)
\(\Rightarrow n_C=\dfrac{m}{M}=\dfrac{132}{12}=11\left(mol\right)\\ n_H=\dfrac{m}{M}=\dfrac{14}{1}=14\left(mol\right)\\ n_O=\dfrac{m}{M}=\dfrac{32}{16}=2\left(mol\right)\)
\(CTHH:C_{11}H_{14}O_2\Rightarrow D\)
Đúng 1
Bình luận (0)
























