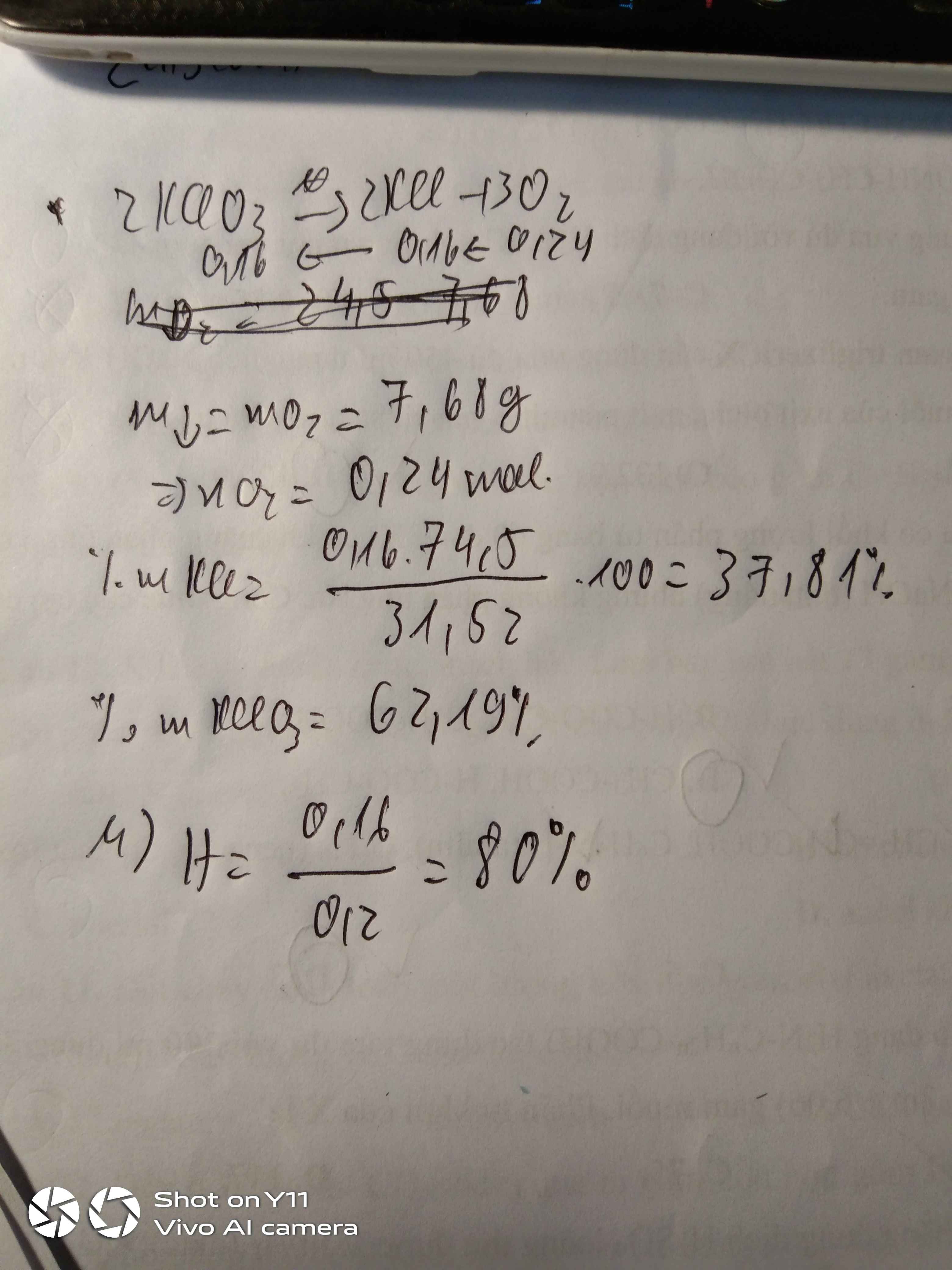Nhiệt phân 100g KClO3 , sau một thời gian thấy còn 90,4 g hỗn hợp chất rắn. Tính khối lượng từng chất trong hỗn hợp chất rắn.

Những câu hỏi liên quan
Nhiệt phân 24,5 gam kali clorat KClO3 một thời gian thu được hỗn hợp rắn X có khối lượng giảm 7,68 gam so với khối lượng chất ban đầu .
a) Tính phần trăm khối lượng của mỗi chất trong hỗn hợp rắn X
b) Tính hiệu suất phản ứng nhiệt phân.
nung nóng 20g KMnO4 một thời gian thấy khối lượng hỗn hợp rắn còn lại là 17,12g . Tính khối lượng các chất trong hỗn hợp rắn sau phản ứng
\(n_{O_2}= \dfrac{20-17,12}{32} = 0,09(mol) \)
2KMnO4 \(\xrightarrow{t^o}\) K2MnO4 + MnO2 + O2
0,18................0,09.........0,09.....0,09...............(mol)
Sau phản ứng,
\(m_{KMnO_4} = 20-0,18.158 = -8,44 <0\)(Sai đề)
Đúng 1
Bình luận (0)
Ta có PTHH: 2KMnO4 -----> K2MnO4 + MnO2 + O2.
Ta có: nKMnO4= 20/158=0,1(mol)
Theo PT, ta có: nK2MnO4= 1/2 . 0,1=0,05(mol)
=> mK2MnO4= 0,05.197=9,85(g)
nMnO2=nK2MnO4=0,05(mol)
=> mMnO2=0,05.87=4,35(g)
=> Khối lượng của chất rắn sau phản ứng là: 9,85+4,35=14,2(g)
(Chúc bạn làm tốt nhé ![]() )
)
Đúng 1
Bình luận (0)
cho a gam hỗn hợp gồm KClO3 và NaCl trong đó NaCl chiếm 25% về khối lượng.
Nung hỗn hợp ở nhiệt độ cao thu được chất rắn có khối lượng bằng 90,4% khối lượng hỗn hợp chất rắn ban đầu . tính thành phần phần trăm theo khối lượng các chất rắn thu được sau phản ứng . Biết NaCl khi nung ko bị phân hủy
2KClO3 -to-> 2KCl + 3O2 (1)
NaCl --đpnc--> Na +Cl2 (2)
mNaCl=25/100 .a=0,25a(g)
=>nNaCl=0,25a/58,5=0,0042a(mol)
mKClO3=a - 2,5a=0,75a(g)
=> nKClO3=0,75a/122,5=0,0061a(mol)
mchất rắn thu được=90,4/100 .a=0,904a(g)
theo (1): nKCl=nKClO3=0,0061a(mol)
=>mKCl=0,0061a.74,5=0,455a(g)
theo (2) : nNa=nNaCl=0,0042a(mol)
=>mNa=0,0042.23=0,096a(mol)
=>%mKCl =0,455a/0,904a .100=50,33(%)
%mNa=0,0966a/0,904a .100=10,68(%)
Đúng 0
Bình luận (0)
cho a gam hỗn hợp gồm KClO3 và NaCl trong đó NaCl chiếm 25% về khối lượng.
Nung hỗn hợp ở nhiệt độ cao thu được chất rắn có khối lượng bằng 90,4% khối lượng hỗn hợp chất rắn ban đầu . tính thành phần phần trăm theo khối lượng các chất rắn thu được sau phản ứng . Biết NaCl khi nung ko bị phân hủy
Khối lượng của các chất trong hỗn hợp ban đầu là:
\(\left\{{}\begin{matrix}m_{KClO_3}=75\%a=0,75a\\m_{NaCl}=25\%a=0,25a\end{matrix}\right.\)
\(2KClO_3\left(x\right)\rightarrow2KCl\left(x\right)+3O_2\)
Gọi số mol KClO3 bị phân hủy là x
\(\Rightarrow m_{KCl}=74,5x\left(g\right)\)
\(\Rightarrow m_{KClO_3\left(pứ\right)}=122,5x\left(g\right)\)
\(\Rightarrow m_{KClO_3\left(dư\right)}=0,75a-122,5x\left(g\right)\)
Thành phần chất rắn sau phản ứng là:
\(\left\{{}\begin{matrix}m_{NaCl}=0,25a\\m_{KCl}=74,5x\\m_{KClO_3\left(dư\right)}=0,75a-122,5x\end{matrix}\right.\)
\(\Rightarrow m_{hhspu}=0,25a+74,5x+0,75a-122,5x=a-48x\)
Theo đề bài ta có:
\(\dfrac{a-48x}{a}.100\%=90,4\%\)
\(\Leftrightarrow a=500x\)
Từ đây ta có phần trăm theo khối lượng của hh sau phản ứng là:
\(\left\{{}\begin{matrix}\%NaCl=\dfrac{0,25a}{a-48x}.100\%=\dfrac{0,25.500x}{500x-48x}.100\%=27,65\%\\\%KCl=\dfrac{74,5x}{a-48x}.100\%=\dfrac{74,5x}{500x-48x}.100\%=16,48\%\\\%KClO_3\left(dư\right)=100\%-27,65\%-16,48\%=55,87\%\end{matrix}\right.\)
Đúng 0
Bình luận (0)
Nung 43,3 gam hỗn hợp gồm KMnO4 và KClO3. Sau một thời gian thu được khí X và chất rắn Y. Nguyên tố Mn chiếm 24,103% khối lượng chất rắn Y. Tính khối lượng của KMnO4 và KClO3 trong hỗn hợp ban đầu. Biết hiệu suất các phản ứng đều đạt 90%.
Gọi n KMnO4 = a
n KClO3 = b ( mol )
--> 158a + 122,5 b = 43,3
PTHH :
\(2KClO_3\underrightarrow{t^o}2KCl+3O_2\uparrow\)
0,9b 1,35b
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\uparrow\)
0,9a 0,45a
\(\%Mn=\dfrac{55a}{43,3-32\left(0,45a+1,35b\right)}=24,103\%\)
\(\rightarrow a=0,15\)
\(b=0,16\)
\(m_{KMnO_4}=0,15.158=23,7\left(g\right)\)
\(m_{KClO_3}=0,16.122,5=19,6\left(g\right)\)
Đúng 3
Bình luận (0)
Nung nóng 50g KCLO3 một thời gian thấy khối lượng hỗn hợp chất rắn còn lại là 73.6 gam . Hãy tính khối lượng mỗi chất trong hỗn hợp chất rắn sau phản ứng
Cả nhà ơi giúp mk bài này vs ạ ><
2KClO3--->2KCl+3O2
Áp dụng định luật bảo tàn khối lượng ta có
m\(_{O2}=m_{KClO3}-m_{KCl}=80-73,6=6,4\left(g\right)\)
n\(_{O2}=\frac{6,4}{32}=0,2\left(mol\right)\)
Theo pthh
n KClO3=2/3 n O2=0,133(mol)
m KClO3 phản ứng=0,133.122,5=16,29(g)
m KClO3 dư=80-16,29=63,71(g)
Theo pthh
n KCl=2/3n O2=0,133(mol)
m KCl phản ứng =0,133.74,5=9,9(g)
--->m KCl dư=73,6-9,9=63,7(g)
Làm lại nà
KClO4--->KCl+2O2
Áp dụng định luật bảo toàn khối lượng ta có
m O2=m KClO4-m KCl=80-73,6=6,4(g)
n O2=6,4/32=0,2(mol)
Theo pthh
n KClO4=1/2 n O2 =0,1(mol)
m KClO4=0,1.138,5=12,85(g)
m KClO4 dư=80-12,85=67,15(g)
Theo pthh
n KCl=1/2n O2=0,1(mol)
m KCl=0,1.74,5=7,45(g)
m KCl dư=73,6-7,45=66,15(g)
Gọi số mol KClO4 phản ứng là x
\(\text{KClO4-->KCl+2O2}\)
x--------->x--------->2x
Ta có :
\(\text{80-2x}.\text{32=73,6}\)
\(\Rightarrow\text{mKCl sau phản ứng=}0,1.74,5\text{=7.45g}\)
\(\Rightarrow\text{mKClO4 dư =73,6-7,45=66,15}\)
Xem thêm câu trả lời
Nung nóng 79 gam KMnO4 một thời gian thu được hỗn hợp chất rắn A nặng 74,2 gam.1) Tính hiệu suất phản ứng nhiệt phân.2) Cho A tác dụng với lượng dư axit HCl đặc, dẫn toàn bộ lượng khí tạo ra đi qua ống sứ đựng 29,6 gam hỗn hợp B gồm Fe, Cu. Sau khi các phản ứng hoàn toàn, thấy khối lượng chất rắn trong ống là 75,75 gam. Xác định % khối lượng mỗi chất có trong chất rắn còn lại trong ống sứ.
Đọc tiếp
Nung nóng 79 gam KMnO4 một thời gian thu được hỗn hợp chất rắn A nặng 74,2 gam.
1) Tính hiệu suất phản ứng nhiệt phân.
2) Cho A tác dụng với lượng dư axit HCl đặc, dẫn toàn bộ lượng khí tạo ra đi qua ống sứ đựng 29,6 gam hỗn hợp B gồm Fe, Cu. Sau khi các phản ứng hoàn toàn, thấy khối lượng chất rắn trong ống là 75,75 gam. Xác định % khối lượng mỗi chất có trong chất rắn còn lại trong ống sứ.
2KMnO4--->MnO2+O2+K2MnO4 (1)
theo bài ra ta có
nKMnO4= \(\frac{79}{158}=0,5\)(mol)
hỗn hợp chất rắn A gồm MnO2 và K2MnO4
theo phương trình (1) ta có
nMnO2= \(\frac{1}{2}x0,5\)= 0,25 (mol)
---> mMnO2= 0.25 x 87=21,75 (g)
nK2MnO4= \(\frac{1}{2}x0,5\)= 0,25 (mol)
----> m K2MnO4= 0,25 x 197=49,25 (g)
--->mA= 21,75+49,25=71 (g)
---> H%= \(\frac{71}{74,2}x100\%\approx95,69\%\)
2)
2) K2MnO4+8 HCl đặc----> 2Cl2+4H2O+2KCl+MnCl2 (2)
MnO2+4 HCl đặc ---> MnCl2 +Cl2+2 H2O (3)
khí thu được là Cl2
Cl2+ Cu-->CuCl2 (4)
3Cl2+2 Fe---> 2FeCl3 (5)
gọi số mol CuCl2 là x (x>0 ;mol)
--> mCucl2= 135x (g)
gọi số mol FeCl3 là y (y>0 ;mol)
---> n FeCl3=162,5 (g)
theo bài ra ta có 135x+162,5y=75,75( ** )
theo phương trình (4) ta có
nCu= nCuCl2=x(mol)
--> mCu= 64x (g)
theo phương trình (5) ta có
nFe=nFeCl3=y (mol )
--> mFe=56y (g)
theo bài ra ta có
64x+56y= 29,6 ( ** )
từ ( * ) và ( ** ) ta có hệ phương trình
\(\hept{\begin{cases}135x+162,5y=75,75\\64x+56y=29,6\end{cases}}\)
=> \(\hept{\begin{cases}x=0,2\\y=0,3\end{cases}}\)
=> mCuCl2= 0,2 x 135=27(g)
mFeCl3= 0,3 x 162,5= 48,75 (g)
LƯU Ý: bạn ghi ngoặc ở phép tính cuối và bạn tự giải phương trình hoặc liên hệ với mình
Nhiệt phân hoàn toàn 99,95 gam hỗn hợp KMnO4 và KClO3 sau phản ứng thu đc 14,56 lít khí O2 ở đktc
a) Tính % theo khối lượng mỗi chất có trong hỗn hợp trước phản ứng
b) Tính % khối lượng mỗi chất rắn có trong hỗn hợp sau phản ứng
\(a)n_{KMnO_4} = a; n_{KClO_3} = b\Rightarrow 158a + 122,5b = 99,95(1)\\ 2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2\\ 2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2\\ n_{O_2} = 0,5a +1,5b = \dfrac{14,56}{22,4}=0,65(2)\\ (1)(2)\Rightarrow a = 0,4 ; b = 0,3\\ \%m_{KMnO_4} = \dfrac{0,4.158}{99,95}.100\% = 63,23\%\\ \%m_{KClO_3} = 100\%-63,23\% = 36,77\%\)
\(n_{K_2MnO_4} = n_{MnO_2} = 0,5a = 0,2(mol)\\ n_{KClO_3} = b = 0,3(mol)\\ m_{hh\ sau\ pư} = 99,95 - 0,65.32 = 79,15(gam)\\ \%m_{K_2MnO_4} = \dfrac{0,2.197}{79,15}.100\% = 49,78\%\\ \%m_{MnO_2} = \dfrac{0,2.87}{79,15},100\% = 21,98\%\\ \%m_{KCl} = 28,24\%\)
Đúng 1
Bình luận (0)
![]() ko khó lém bn ơi có câu nèo easy hơm ko
ko khó lém bn ơi có câu nèo easy hơm ko![]()
Đúng 0
Bình luận (0)
Nung nóng 20 g KMnO4 một thời gian thấy khối lượng hỗn hợp chất rắn còn lại là 17,12 gam. Hãy tính khối lượng mỗi chất trong hỗn hợp chất rắn sau phản ứng.
2KMnO4-to->K2MnO4+MnO2+O2
0,126-------------0,063------0,063 mol
nKMnO4=20\158=0,126mol
=>mChất rắn=0,063.197+0,063.87=17,892g
Đúng 0
Bình luận (0)