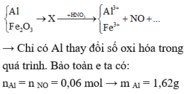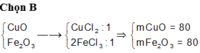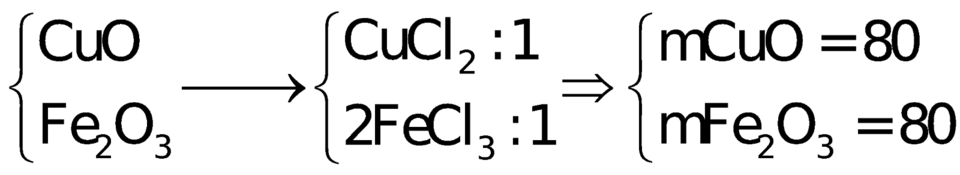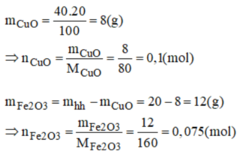Một hỗn hợp gồm Fe2O3&MgO nặng 16g đc hòa tan hết trong dd HCl sau đó đem cô cạn dd thu đc 35,25g muối khan a. Viết PTHH xảy ra b. Tính % khối lượng mỗi muối trong hỗn hợp ban đầu c.tính Vdd HCl 20%(D=1.1g/mol)cần dùng vừa đủ để hòa tan hỗn hợp trên

Những câu hỏi liên quan
một hỗn hợp gồm A(g) gồm CuO, Fe2O3 được khử hoàn toàn bằng H2 ở nhiệt độ cao sau phản ứng thu được 0,72 A(g) hỗn hợp 2 kim loại . tính thành phần % về khối lượng của CuO,Fe2O3 trong hỗn hợp giúp mình vs ạ mk sắp thi
Bạn xem lại xem đề có thiếu gì không nhé.
Đúng 1
Bình luận (0)
a. Có hỗn hợp chất rắn gồm Al2O3 và Fe2O3. Hãy táchriêng Fe2O3 ra khỏi hỗn hợp bằng phương pháp hóa học. ViếtPTHH minh họa nếu có.b. Có hỗn hợp chất rắn gồm CaO và Fe2O3. Hãy tách riêngFe2O3 ra khỏi hỗn hợp bằng phương pháp hóa học. Viết PTHHminh họa nếu có.c. Có ba chất rắn là BaO, SiO2, MgO. Dùng phương pháp hóahọc để nhận biết chúng.d. Phân biệt CaO và P2O5 bằng phương pháp hóa học, viếtPTHH minh họa nếu có.e. Phân biệt CO2 và SO2 bằng phương pháp hóa học, viết PTHHminh họa nếu có
Đọc tiếp
a. Có hỗn hợp chất rắn gồm Al2O3 và Fe2O3. Hãy tách
riêng Fe2O3 ra khỏi hỗn hợp bằng phương pháp hóa học. Viết
PTHH minh họa nếu có.
b. Có hỗn hợp chất rắn gồm CaO và Fe2O3. Hãy tách riêng
Fe2O3 ra khỏi hỗn hợp bằng phương pháp hóa học. Viết PTHH
minh họa nếu có.
c. Có ba chất rắn là BaO, SiO2, MgO. Dùng phương pháp hóa
học để nhận biết chúng.
d. Phân biệt CaO và P2O5 bằng phương pháp hóa học, viết
PTHH minh họa nếu có.
e. Phân biệt CO2 và SO2 bằng phương pháp hóa học, viết PTHH
minh họa nếu có
a)
Cho hỗn hợp vào dung dịch $NaOH$ lấy dư, thu lấy phần không tan được $Fe_2O_3$
$2NaOH + Al_2O_3 \to 2NaAlO_2 + H+2O$
b)
Cho mẫu thử vào nước, thu lấy phần không tan được $Fe_2O_3$
$CaO + H_2O \to Ca(OH)_2$
c)
Cho mẫu thử vào nước
- tan là $BaO$
$BaO + H_2O \to Ba(OH)_2$
Cho 2 mẫu thử còn vào dd $HCl$
- mẫu thử tan là $MgO$
$MgO + 2HCl \to MgCl_2 + H_2O$
- không tan là $SiO_2$
Đúng 1
Bình luận (0)
a.
Hòa tan hỗn hợp vào dung dịch NaOH dư :
- Al2O3 tan hoàn toàn tạo thành dung dịch
- Fe2O3 không tan , lọc lấy
\(2NaOH+Al_2O_3\rightarrow2NaAlO_2+H_2O\)
b.
Hòa tan hỗn hợp vào nước
- CaO tan hoàn toàn tạo thành dung dịch
- Fe2O3 không tan , lọc lấy
\(CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
Đúng 1
Bình luận (0)
d)
Trích mẫu thử
Cho giấy quỳ tím ẩm vào các mẫu thử
- mẫu thử làm quỳ tím hóa đỏ là $P_2O_5$
$P_2O_5 + 3H_2O \to 2H_3PO_4$
- mẫu thử làm quỳ tím hóa xanh là $CaO$
$CaO + H_2O \to Ca(OH)_2$
c)
Trích mẫu thử
Sục các mẫu thử vào dd brom dư
- mẫu thử làm nhạt màu nước brom là $SO_2$
$SO_2 + Br_2 + 2H_2O \to 2HBr + H_2SO_4$
- mẫu thử không HT là $CO_2$
Đúng 1
Bình luận (0)
Xem thêm câu trả lời
Nung hỗn hợp bột gồm Al và
Fe
2
O
3
trong bình kín một thời gian thu được hỗn hợp X gồm Fe, FeO,
Fe
2
O
3
,
Fe
3
O
4
và Al. Hòa tan hết X trong bằng dung dịch
HNO
3
dư thu được 1,344 lít (đktc) khí NO (là sản ph...
Đọc tiếp
Nung hỗn hợp bột gồm Al và Fe 2 O 3 trong bình kín một thời gian thu được hỗn hợp X gồm Fe, FeO, Fe 2 O 3 , Fe 3 O 4 và Al. Hòa tan hết X trong bằng dung dịch HNO 3 dư thu được 1,344 lít (đktc) khí NO (là sản phẩm khử duy nhất). Khối lượng của Al trong hỗn hợp đầu là:
A. 0,54 gam
B. 0,27 gam
C. 1,62 gam
D. 0,81 gam
Cho một lượng hỗn hợp gồm CuO, Fe2O3 tan hết trong dung dịch HCl thu được 2 muối có tỉ lệ mol 1: 1. Phần trăm khối lượng CuO và Fe2O3 trong hỗn hợp lần lượt là:
A. 45,38% và 54,62%
B. 50% và 50%
C. 54,62% và 45,28%
D. 33,33% và 66,67%
Đáp án B
CuO + 2HCl → CuCl2 + H2O
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Giả sử số mol 2 muối CuCl2 và FeCl3 đều là 1 mol
=> nCuO = nCuCl2 = 1 mol ; nFe2O3 = 0,5nFeCl3 = 0,5 mol
=> mhh đầu = 80.1 + 160.0,5 = 160g
=> %mCuO = %mFe2O3 = 50%
Đúng 0
Bình luận (0)
Cho CO đi qua 70,25 gam hỗn hợp X gồm Fe2O3 và một oxit của kim loại R (R có hóa trị không đổi) nung nóng thu được 3,36(l) khí CO2 và hỗn hợp Y gồm Fe, Fe2O3, FeO, Fe3O4, oxit của kim loại R. Hỗn hợp Y phản ứng vừa đủ với 750ml H2SO4 1M thu được 1,12 lít khí H2và hỗn hợp Z.Thêm tiếp dung dịch NaOH từ từ cho tới dư vào hh Z, sau phản ứng hòan toàn thu được kết tủa T. Lọc T để ngoài không khí đến khối lượng không đổi thu được 101,05 gam chất rắn. Xác định CT của oxit kim loại R
Đọc tiếp
Cho CO đi qua 70,25 gam hỗn hợp X gồm Fe2O3 và một oxit của kim loại R (R có hóa trị không đổi) nung nóng thu được 3,36(l) khí CO2 và hỗn hợp Y gồm Fe, Fe2O3, FeO, Fe3O4, oxit của kim loại R. Hỗn hợp Y phản ứng vừa đủ với 750ml H2SO4 1M thu được 1,12 lít khí H2và hỗn hợp Z.Thêm tiếp dung dịch NaOH từ từ cho tới dư vào hh Z, sau phản ứng hòan toàn thu được kết tủa T. Lọc T để ngoài không khí đến khối lượng không đổi thu được 101,05 gam chất rắn. Xác định CT của oxit kim loại R

Chào bạn tuy không thể giúp bạn nhưng cho mình hỏi bạn có bị mất thanh thông báo tin nhắn như mình không ạ
Đúng 0
Bình luận (3)
Oxit kim loại R : \(R_2O_n\)
\(n_{Fe_2O_3} = a(mol) ; n_{R_2O_n} = b(mol)\\ \Rightarrow 160a + b(2R + 16n) = 70,25(1)\)
\(n_{CO} = n_{CO_2} = 0,15(mol)\)
\(CO + O_{oxit} \to CO_2\)
\(n_{O\ pư} = n_{CO_2} = 0,15(mol)\)
\(2H^+ \to H_2 + 2e\\ 2H^+ + O^{2-} \to H_2O\)
Ta có : \(n_{H^+} =2n_{H_2SO_4} = 2n_{H_2} + 2n_{O(Y)}\)
\(\Rightarrow n_{O(Y)} = 0,7(mol)\)
Bảo toàn nguyên tố với O : 3a + bn = 0,7 + 0,15 = 0,85(2)
Sau phản ứng, không thu được kim loại R,chứng tỏ R không phản ứng với CO
Mà sau khi nung T thu được khối lượng oxit lớn hơn khối lượng X ban đầu. Chứng tỏ muối sunfat của kim loại R không tan trong nước.
Vậy,101,05 gam chất rắn gồm :
\(Fe(OH)_3 : 2a(mol)\\ R_2(SO_4)_n : b(mol)\)
⇒107.2a + b(2R + 96n) = 101,05(3)
Từ (1)(2)(3) suy ra a = 0,2 ; Rb = 17,125 ; bn = 0,25
Suy ra :\(R = \dfrac{17,125}{\dfrac{0,25}{n}} = \dfrac{137}{2}n\)
Với n = 2 thì R = 137(Ba) .Vậy oxit : BaO
Đúng 2
Bình luận (4)
Cho một lượng hỗn hợp gồm CuO, Fe2O3 tan hết trong dung dịch HCl thu được 2 muối có tỉ lệ mol là 1 : 1. Phần trăm khối lượng CuO và Fe2O3 trong hỗn hợp lần lượt là A. 45,38% và 54,62%. B. 50% và 50%. C. 54,63% và 45,38%. D. 33,33% và 66,67%
Đọc tiếp
Cho một lượng hỗn hợp gồm CuO, Fe2O3 tan hết trong dung dịch HCl thu được 2 muối có tỉ lệ mol là 1 : 1. Phần trăm khối lượng CuO và Fe2O3 trong hỗn hợp lần lượt là
A. 45,38% và 54,62%.
B. 50% và 50%.
C. 54,63% và 45,38%.
D. 33,33% và 66,67%
Cho một lượng hỗn hợp gồm CuO, Fe2O3 tan hết trong dung dịch HCl thu được 2 muối có tỉ lệ mol là 1 : 1. Phần trăm khối lượng CuO và Fe2O3 trong hỗn hợp lần lượt là A. 45,38% và 54,62%. B. 50% và 50%. C. 54,63% và 45,38%. D. 33,33% và 66,67%.
Đọc tiếp
Cho một lượng hỗn hợp gồm CuO, Fe2O3 tan hết trong dung dịch HCl thu được 2 muối có tỉ lệ mol là 1 : 1. Phần trăm khối lượng CuO và Fe2O3 trong hỗn hợp lần lượt là
A. 45,38% và 54,62%.
B. 50% và 50%.
C. 54,63% và 45,38%.
D. 33,33% và 66,67%.
Hỗn hợp A gồm Fe2O3, Al2O3, SiO2. Để tách riêng Fe2O3 ra khỏi hỗn hợp A, hóa chất cần chọn: A. Dung dịch NH3 B. Dung dịch HCl C. Dung dịch NaOH D. Dung dịch HNO3
Đọc tiếp
Hỗn hợp A gồm Fe2O3, Al2O3, SiO2. Để tách riêng Fe2O3 ra khỏi hỗn hợp A, hóa chất cần chọn:
A. Dung dịch NH3
B. Dung dịch HCl
C. Dung dịch NaOH
D. Dung dịch HNO3
Một hỗn hợp gồm Fe và Fe2O3 tác dụng hết với dd HCl thu đc 2,24 (l) khí (đktc) và 1 dd gồm 45,2 (g) hỗn hợp 2 muối
.a, Tìm khối lượng mỗi muối trong hỗn hợp
.b, Xác định khối lượng của hỗn hợp ban đầu
a) PTHH: Fe + 2 HCl -> FeCl2 + H2
nH2= 0,1(mol)
-> nFe= nFeCl2=nH2=0,1(mol)
=>mFeCl2=127.0,1=12,7(g)
PTHH: Fe2O3+ 6 HCl -> 2 FeCl3 + 3 H2O
mFeCl3= m(hỗn hợp muối)- mFeCl2= 45,2- 12,7= 32,5(g)
b) => nFeCl3= 0,2(mol)
=> nFe2O3= nFeCl3/2= 0,2/2= 0,1(mol)
=> m(hỗn hợp ban đầu)= mFe+ mFe2O3= 0,1. 56+ 0,1.160=21,6(g)
Đúng 2
Bình luận (0)
a) PTHH: Fe + 2 HCl -> FeCl2 + H2
nH2= 0,1(mol)
-> nFe= nFeCl2=nH2=0,1(mol)
=>mFeCl2=127.0,1=12,7(g)
PTHH: Fe2O3+ 6 HCl -> 2 FeCl3 + 3 H2O
mFeCl3= m(hỗn hợp muối)- mFeCl2= 45,2- 12,7= 32,5(g)
b) => nFeCl3= 0,2(mol)
=> nFe2O3= nFeCl3/2= 0,2/2= 0,1(mol)
=> m(hỗn hợp ban đầu)= mFe+ mFe2O3= 0,1. 56+ 0,1.160=21,6(g)
Đúng 1
Bình luận (1)
Có một hỗn hợp gồm 60% F e 2 O 3 và 40% CuO. Người ta dùng H 2 ( dư) để khử 20g hỗn hợp đó. Tính số mol H 2 tham gia phản ứng.