Khối lượng khí oxi thu được sau khi phân huỷ hoàn toàn 15,8 gam KMnO4 là (K = 39, Mn = 55, O = 16)

Những câu hỏi liên quan
Khi phân huỷ hoàn toàn 47,4 gam KMnO4, thể tích khí oxi (đktc) thu được là
(Cho K=39, Mn=55, O=16)
1,12 lít
2,24 lít
4,48 lít
3,36 lít
Nhiệt phân hoàn toàn 31,6 gam KMnO4 để điều chế oxi. Thể tích khí O2 thu được ở đktc là:(K 39; Mn 55; O 16) A.8,96 lít B.4,48 lít C.1,12 lít D.2,24 lít
Đọc tiếp
Nhiệt phân hoàn toàn 31,6 gam KMnO4 để điều chế oxi. Thể tích khí O2 thu được ở đktc là:
(K = 39; Mn = 55; O = 16)
A.8,96 lít
B.4,48 lít
C.1,12 lít
D.2,24 lít
Nhiệt phân hoàn toàn 31,6 gam KMnO4 để điều chế oxi. Thể tích khí O2 thu được ở đktc là:
(K = 39; Mn = 55; O = 16)
A.
8,96 lít
B.
4,48 lít
C.
1,12 lít
D.
2,24 lít
Đúng 1
Bình luận (0)
Tham khảo:
= 31,6/158 = 0,2 (mol)
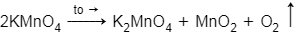
⇒ V = 0,1.22,4 = 2,24 (lít)
Đúng 1
Bình luận (1)
Xem thêm câu trả lời
Câu 1. Muốn điều chế được 4,48 lít khí oxi (đktc) thì khối lượng KMnO4 cần nhiệt phân là bao nhiêu? (Cho nguyên tử khối: O 16, K 39, Mn 55)Câu 2. Đốt cháy 6,2 gam photpho với 6,4 gam oxi trong không khí, sản phẩm thu được là điphotpho pentaoxit (P2O5).a. Viết PTHH của phản ứng.b. Sau phản ứng chất nào còn dư và số mol chất còn dư là bao nhiêu?b. Tính khối lượng sản phẩm tạo thành.
Đọc tiếp
Câu 1. Muốn điều chế được 4,48 lít khí oxi (đktc) thì khối lượng KMnO4 cần nhiệt phân là bao nhiêu? (Cho nguyên tử khối: O = 16, K = 39, Mn = 55)
Câu 2. Đốt cháy 6,2 gam photpho với 6,4 gam oxi trong không khí, sản phẩm thu được là điphotpho pentaoxit (P2O5).
a. Viết PTHH của phản ứng.
b. Sau phản ứng chất nào còn dư và số mol chất còn dư là bao nhiêu?
b. Tính khối lượng sản phẩm tạo thành.
C1:
nO2 = 4,48/22,4 = 0,2 (mol)
PTHH: 2KMnO4 -> (t°) K2MnO4 + MnO2 + O2
nKMnO4 = 0,2 . 2 = 0,4 (mol)
mKMnO4 = 0,4 . 158 = 63,2 (g)
C2:
nP = 6,2/31 = 0,2 (mol)
nO2 = 6,4/32 = 0,2 (mol)
PTHH: 4P + 5O2 -> (t°) 2P2O5
LTL: 0,2/4 > 0,2/5 => P dư
nP2O5 = 0,2/5 . 2 = 0,08 (mol)
mP2O5 = 0,08 . 142 = 11,36 (g)
Đúng 3
Bình luận (0)
Nhiệt phân hoàn toàn 15,8 g KMnO4 thu được v lít khí Oxi a Tính v b đốt cháy 5,6 gam sắt trong V lít khí Oxi nói trên sản phẩm thu được là oxit sắt từ fe3 o4 tính khối lượng chất rắn thu được sau phản ứng
PTHH: \(2KMnO_4\xrightarrow[]{t^o}K_2MnO_4+MnO_2+O_2\)
\(n_{KMnO_4}=\dfrac{m_{KMnO_4}}{M_{KMnO_4}}=\dfrac{15,8}{158}=0,1\left(mol\right)\)
a. Theo PTHH: \(n_{O_2}=\dfrac{1}{2}n_{KMnO_4}=\dfrac{1}{2}0,1=0,05\left(mol\right)\)
\(\Rightarrow V_{O_2}=n_{O_2}.22,4=0,05.22,4=1,12\left(l\right)\)
b. PTHH: \(3Fe+2O_2\xrightarrow[]{t^o}Fe_3O_4\)
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
Ta có: \(\dfrac{1}{n_{O_2}}=\dfrac{1}{0,05}\)
\(\dfrac{1}{n_{Fe}}=\dfrac{1}{0,1}\)
\(\Rightarrow\dfrac{1}{n_{O_2}}>\dfrac{1}{n_{Fe}}\)
Vậy Fe dư
Theo PTHH: \(n_{Fe_3O_4}=\dfrac{0,1.1}{3}=\dfrac{1}{30}\left(mol\right)\)
\(\Rightarrow m_{Fe_3O_4}=n_{Fe_3O_4}.M_{Fe_3O_4}=\dfrac{1}{30}.232\approx7,73g\)
Đúng 2
Bình luận (0)
Người ta đun nóng hết 47,4 gam KMnO4 để thu khí oxygen.
a) Tính thể tích khí oxygen thu được (đkc).
b) Dùng toàn bộ lượng oxygen trên đốt cháy hoàn toàn m gam Al. Tính khối lượng Al tham gia phản ứng và khối lượng sản phẩm thu được. K = 39, Mn = 55, O = 16, Al = 27.
a. \(n_{KMnO_4}=\dfrac{47.4}{158}=0,3\left(mol\right)\)
PTHH : 2KMnO4 ---to----> K2MnO4 + MnO2 + O2
0,3 0,15
\(V_{O_2}=0,15.22,4=3,36\left(l\right)\)
b. PTHH : 4Al + 3O2 -> 2Al2O3
0,2 0,15
\(m_{Al}=0,2.27=5,4\left(g\right)\)
Đúng 5
Bình luận (1)
Đốt cháy hoàn toàn 11,2 lít khí hidro trong khí oxi. a) Viết PTHH của phản ứng b) tính khối lượng và thể tích oxi cần dùng c) tính số gam KMnO4 cần dùng để có đc lượng oxi cho phản ứng trên ( O=16, Mn=55, H=1,K=39 )GIẢI GIÚP MÌNH VS Ạ MÌNH CẦN GẤP 😅
\(n_{H_2}=\dfrac{V}{24,79}=\dfrac{11,2}{24,79}\approx0,45\left(mol\right)\)
a) \(PTHH:2H_2+O_2\underrightarrow{t^o}2H_2O\)
2 1 2
0,45 0,225 0,45
b) \(m_{O_2}=n.M=0,225.\left(16.2\right)=7,2\left(g\right)\\ V_{O_2}=n.24,79=0,225.24,79=5,57775\left(l\right)\)
c) \(PTHH:2KMnO_4\rightarrow K_2MnO_4+MnO_2+O_2\)
2 1 1 1
0,45 0,225 0,225 0,225
\(m_{KMnO_4}=n.M=0,45.\left(39+55+16.4\right)=71,1\left(g\right).\)
Đúng 1
Bình luận (0)
a, \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
b, Ta có: \(n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{1}{2}n_{H_2}=0,25\left(mol\right)\)
\(\Rightarrow m_{O_2}=0,25.32=8\left(g\right)\)
\(V_{O_2}=0,25.22,4=5,6\left(l\right)\)
c, \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
Theo PT: \(n_{KMnO_4}=2n_{O_2}=0,5\left(mol\right)\Rightarrow m_{KMnO_4}=0,5.158=79\left(g\right)\)
Đúng 0
Bình luận (0)
Nhiệt phân hoàn toàn 15,8g KMnO4 thu được bao nhiêu lít khí oxi ở điều kiện tiêu chuẩn? (K=39, Mn=55, O=16)
A. 1,12 lít B. 2,24 lít C. 3,36 lít D. 4,48 lít
\(n_{KMnO_4}=\dfrac{15,8}{158}=0,1mol\)
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
0,1 0,05 ( mol )
\(V_{O_2}=0,05.22,4=1,12l\)
-->A
Đúng 3
Bình luận (0)
\(n_{KMnO_4}=\dfrac{m}{M}=\dfrac{15,8}{158}=0,1mol\)
\(PTHH:2KMnO_4\underrightarrow{t^o}MnO_2+O_2+K_2MnO_4\)
\(2:1:1:1\) \(\left(mol\right)\)
\(0,1:0,05:0,05:0,05\) \(\left(mol\right)\)
\(V_{O_2}=n.22,4=0,05.22,4=1,12l\)
Chọn A
Đúng 1
Bình luận (0)
Nhiệt phân hoàn toàn 39,5 gam KMnO4, toàn bộ khỉ thu được tác dụng hết với lượng Mg du Phản ứng cho ra chất răn có khối lượng lớn hơn khối lượng Mg dùng ban đầu là 32 gam Hiệu suất của phản ứng nhiệt phân KMnO, là (Cho K=39, Mn =55, 0= 16, Mg = 24) A. 60% B. 70% C 80% D. 90%
Câu 25: Muốn điều chế được 3,36 lít khí oxi (đktc) thì khối lượng KMnO4 cần nhiệt phân là bao nhiêu? (Cho: O 16, K 39, Mn 55) A.23,7 gam. B.47,4 gam. C.42,4 gam D. 24,7 gam.Câu 26: Đốt cháy 12,4g photpho trong bình chứa 17g khí oxi tạo thành điphotpho pentaoxit P2O5. Khối lượng sản phẩm tạo thành là (Cho: P 31, O 16)A.56,8 gam.B.42,6 gam. C.71 gam. D.28,4 gam.Câu 27: Cho 4,7 gam K2O tác dụng hoàn toàn với H2O theo phản ứng. K2O + H2O ---[Math Processing Error]→ KOHKhối...
Đọc tiếp
Câu 25: Muốn điều chế được 3,36 lít khí oxi (đktc) thì khối lượng KMnO4 cần nhiệt phân là bao nhiêu? (Cho: O = 16, K = 39, Mn = 55)
A.23,7 gam.
B.47,4 gam.
C.42,4 gam
D. 24,7 gam.
Câu 26: Đốt cháy 12,4g photpho trong bình chứa 17g khí oxi tạo thành điphotpho pentaoxit P2O5. Khối lượng sản phẩm tạo thành là (Cho: P = 31, O = 16)
A.56,8 gam.
B.42,6 gam.
C.71 gam.
D.28,4 gam.
Câu 27: Cho 4,7 gam K2O tác dụng hoàn toàn với H2O theo phản ứng.
K2O + H2O ---[Math Processing Error]→ KOH
Khối lượng KOH thu được sau phản ứng là: (Cho: K = 39, O = 16, H = 1)
A.6,5 gam.
B.6 gam.
C.5 gam.
D.5,6 gam.






























