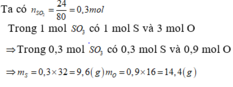Những câu hỏi liên quan
Hãy tính:
(a) Số mol nguyên tử Fe, O trong 4,64 gam Fe3O4.
(b) Số lượng nguyên tử N, O trong 3,36 lít khí N2O (đktc).
(c) Khối lượng nguyên tố H, S, O trong 4,9 gam H2SO4.
a) \(n_{Fe_3O_4}=\dfrac{4,64}{232}=0,02\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}n_{Fe}=3n_{Fe_3O_4}=0,06\left(mol\right)\\n_O=4n_{Fe_3O_4}=0,08\left(mol\right)\end{matrix}\right.\)
b) \(n_{N_2O}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}n_N=2n_{N_2O}=0,3\left(mol\right)\\n_O=n_{N_2O}=0,15\left(mol\right)\end{matrix}\right.\)
c) Ta có: \(n_{H_2SO_4}=\dfrac{4,9}{98}=0,05\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}n_H=2n_{H_2SO_4}=0,1\left(mol\right)\\n_S=n_{H_2SO_4}=0,05\left(mol\right)\\n_O=4n_{H_2SO_4}=0,2\left(mol\right)\end{matrix}\right.\)
Đúng 1
Bình luận (0)
Một hợp chất X có thành phần phần trăm khối lượng mỗi nguyên tố là : %S=40% và %O=60%
Hãy tính khối lượng mỗi nguyên tố có trong 24g hợp chất X.
Một bình thủy tinh kín có chứa 2 gam khí SO3. Hãy tính:
- Thể tích chất khí đó ở đktc.
- Khối lượng nguyên tố S và nguyên tố O.
- Số nguyên tử mỗi nguyên tố trong phân tử trên.
\(n_{SO_3}=\dfrac{2}{80}=0,025\left(mol\right)\\ V_{SO_3}=0,025.22,4=0,56\left(l\right)\\ m_S=0,025.32=0,8\left(g\right)\\ m_O=0,025.48=1,2\left(g\right)\\ 1nguyêntửS,3nguyêntửO\)
Đúng 0
Bình luận (0)
Đồng có 2 đồng vị : và , nguyên tử khối trung bình của nguyên tố Cu là 63,54.a. Tính phần trăm số nguyên tử của từng đồng vị của nguyên tố Cu.b. Tính phần trăm khối lượng của đồng vị chứa trong CuSO4. ( với O là đồng vị , S là đồng vị )c. Tính số nguyên tử của đồng vị có trong 35,77 gam Cu2O.Câu 10. Viết cấu hình electron của các nguyên tử có phân lớp ngoài cùng là 4s1
Đọc tiếp
Đồng có 2 đồng vị : và , nguyên tử khối trung bình của nguyên tố Cu là 63,54.
a. Tính phần trăm số nguyên tử của từng đồng vị của nguyên tố Cu.
b. Tính phần trăm khối lượng của đồng vị chứa trong CuSO4. ( với O là đồng vị , S là đồng vị )
c. Tính số nguyên tử của đồng vị có trong 35,77 gam Cu2O.
Câu 10. Viết cấu hình electron của các nguyên tử có phân lớp ngoài cùng là 4s1
a)Tính thành phần % về khối luongự các nguyên tố có trong khí SO3?
b) Tính khối lượng ng tố S và O có trong 12,8g khí SO3?
a) ta có PTK của SO3=80g/mol
=> %S =\(\frac{32}{80}.100=40\%\)
=> %O=100-40=60%
b) theo câu a thì S chiếm 40%
=> khối lượng nguyên tố S trong 12,8g SO3 là :
\(\frac{12,8}{100}.40=5,12g\)
=> khối lượng O là : 12,8-5,12=7,68g
Đúng 0
Bình luận (0)
1/ a. Một loại phân đạm có công thức (NH4)2SO4 em hãy tính phần trăm theo khối lượng của các nguyên tố trong hợp chất ?b/ Tính khối lượng nguyên tố dinh dưỡng N có trong 20kg phân đạm trên? (N 14; H1; S32; O16)
Đọc tiếp
1/ a. Một loại phân đạm có công thức (NH4)2SO4 em hãy tính phần trăm theo khối lượng của các nguyên tố trong hợp chất ?
b/ Tính khối lượng nguyên tố dinh dưỡng N có trong 20kg phân đạm trên? (N= 14; H=1; S=32; O=16)
\(a.\%m_N=\dfrac{14.2}{\left(14+4.1\right).2+32+4.16}.100\approx21,212\%\\ \%m_H=\dfrac{4.2}{\left(14+4.1\right).2+32+4.16}.100\approx6,061\%\\ \%m_S=\dfrac{32}{\left(14+4.1\right).2+32+4.16}.100\approx24,242\%\\ \%m_O=\dfrac{4.16}{\left(14+4.1\right).2+32+4.16}.100\approx48,485\%\)
\(b.m_{N\left(20kg\right)}=20.\dfrac{2.14}{\left(14+4.1\right).2+32+4.16}.100\%\approx4,2424\left(kg\right)\)
Đúng 2
Bình luận (0)
Copper(II) sulfate có trong thành phần của một số thuốc diệt nấm, trừ sâu và diệt cỏ cho cây trồng. Copper(II) sulfate được tạo thành từ các nguyên tố Cu, S, O và có khối lượng phân tử là 160 amu. Phần trăm khối lượng của các nguyên tố Cu, S và O trong copper(II) sulfate lần lượt là: 40%, 20%, 40%. Hãy xác định công thức hóa học của copper(II) sulfate
Đặt công thức hóa học của copper(II) sulfate là CuxSyOz

Ta có: 64 amu . x = 64 amu => x = 1
32 amu . y = 32 amu => y = 1
16 amu . z = 64 amu => z = 4
Vậy công thức hóa học của copper(II) sulfate là: CuSO4
Đúng 0
Bình luận (0)
Câu1: Nguyên tử một nguyên tố có 7 proton. Hãy xác định nguyên tử khối của nguyên tố đó Câu 2: Có 4 ngtố hóa học: C,S,O,Cu. Hãy cho biết trong số này, ngtử ngtố nào nặng nhất, nhẹ nhất?. Hãy tính tỉ số khối lượng giữa ngtố nặng nhất và nhẹ nhất. Giúp mình nhanh nha
Câu 1 :
Nguyên tố đó là nguyên tố Nito
NTK = 14 đvC
Câu 2 :
$M_C = 12 < M_O = 16 < M_S = 32 < M_{Cu} = 64$
Vậy nguyên tố nhẹ nhất là Cacbon, nguyên tố nặng nhất là Cu
$M_{Cu} : M_C = 64 : 12 = 5,33$
Đúng 2
Bình luận (1)
Chất X chứa S, H, O, N là một kim loại phân bón hóa học. Biết X có phần trăm khối lượng các nguyên tố lần lượt là 24,24%; 6,06%; 48,48% và 21,22%. Hãy:
-xác định tỉ lệ số nguyên tử của các nguyên tố trong X
-tính khối lượng chất X cần lấy để bón cho mảnh vườn cần đc cung cấp 100g nguyên tố nitơ
-
\(n_S:n_H:n_O:n_N=\dfrac{24,24\%}{32}:\dfrac{6,06\%}{1}:\dfrac{48,48\%}{16}:\dfrac{21,22\%}{14}=1:8:4:2\)
-
CTHH của X là (SH8O4N2)n
\(n_N=\dfrac{100}{14}=\dfrac{50}{7}\left(mol\right)\)
=> \(n_{\left(SH_8O_4N_2\right)_n}=\dfrac{\dfrac{50}{7}}{2n}=\dfrac{25}{7n}\left(mol\right)\)
=> \(m_{\left(SH_8O_4N_2\right)_n}=\dfrac{25}{7n}.132n=\dfrac{3300}{7}\left(g\right)\)
Đúng 6
Bình luận (0)
a, CTHH là SxHyOzNt
\(\rightarrow32x:y:16z:14t=24,24:6,06:48,48:21,22\)
\(\rightarrow x:y:z:t=\dfrac{24,24}{32}:\dfrac{6,06}{1}:\dfrac{48,48}{16}:\dfrac{21,22}{14}\)
\(\rightarrow x:y:z:t=1:8:4:2\)
=> CTHH: SH8O4N2
Hay (NH4)2SO4
b, \(n_N=\dfrac{100}{14}=\dfrac{50}{7}\left(g\right)\)
\(\rightarrow n_{\left(NH_4\right)_2SO_4}=\dfrac{50}{7.8}=\dfrac{25}{28}\left(g\right)\\ \rightarrow m_{\left(NH_4\right)_2SO_4}=\dfrac{25}{28}.132=\dfrac{825}{7}\left(g\right)\)
Đúng 4
Bình luận (0)