thành phần phần trăm theo khối lượng của nguyên tố có trong Na2SO4, Fe3O4, Bacl2

Những câu hỏi liên quan
tìm thành phần phần trăm ( theo khối lượng ) của các nguyên tố hóa học có trong nhưng hợp chất sau
a/Fe2O3 b/Fe3O4 c/SO3 d/CuSO4 g/CH4
a) Fe2O3----> \(\dfrac{56.2}{56.2+16.3}.100\%=70\%\\ =>100\%-70\%=30\%\)
Đúng 1
Bình luận (0)
b) Fe3O4---->\(\dfrac{56.3}{56.3+16.4}.100\%=72,41\%\\ =>100\%-72,41\%=27,59\%\)
Đúng 1
Bình luận (0)
c)SO3---->\(\dfrac{32}{32+16.3}.100\%=40\%\\ =>100\%-40\%=60\%\)
Đúng 1
Bình luận (0)
Xem thêm câu trả lời
Tìm thành phần phần trăm (theo khối lượng) các nguyên tố hóa học có trong những hợp chất sau:
a) CO và CO2.
b) Fe3O4 và Fe2O3.
c) SO2 và SO3.
a) Hợp chất CO có MCO = 12 + 16 = 28 g/mol
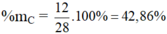
%mO = 100 – 42,86 = 57,14%
Hợp chất CO2: có MCO2 = 12 + 32 = 44 g/mol
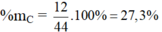
%mO = 100 – 27,3 = 72,7%
b) Hợp chất Fe3O4: MFe3O4 = 3.56 + 4.16 = 232 g/mol
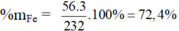
%mO = 100 – 72,4 = 27,6%
Hợp chất Fe2O3: MFe2O3 = 2.56 + 3.16 = 160 g/mol
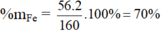
%mO = 100 – 70 = 30%
c) Hợp chất SO2 : MSO2 = 32 + 2.16 = 64 g/mol
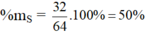
%mO = 100 – 50 = 50%
Hợp chất SO3 : MSO3 = 32 + 16.3 = 80 g/mol
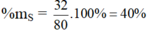
%mO = 100 – 40 = 60%
Đúng 2
Bình luận (0)
Câu 1: Thành phần phần trăm về khối lượng của nguyên tố Fe trong hợp chất Fe3O4 là:A. 72,4%B. 68,8%C. 76%D. 62,5%Câu 2: Hợp chất X có khối lượng mol phân tử là 232 g/mol, thành phần phần trăm khối lượng của Fe là 72,41%, còn lại là của O. Công thức hóa học của X làA. Fe3O4.B. FeO.C. Fe3O2.D. Fe2O3.Câu 3: Trong 1 mol phân tử FeCl3 có bao nhiêu gam nguyên tử clo?A. 71,0 gam.B. 35,5 gam.C. 142,0 gamD. 106,5 gam.Câu 4: Có bao nhiêu mol nguyên tử O trong 1 mol phân tử N2O5?A. 2 mol.B. 4 mol.C. 5 mo...
Đọc tiếp
Câu 1: Thành phần phần trăm về khối lượng của nguyên tố Fe trong hợp chất Fe3O4 là:
A. 72,4%
B. 68,8%
C. 76%
D. 62,5%
Câu 2: Hợp chất X có khối lượng mol phân tử là 232 g/mol, thành phần phần trăm khối lượng của Fe là 72,41%, còn lại là của O. Công thức hóa học của X là
A. Fe3O4.
B. FeO.
C. Fe3O2.
D. Fe2O3.
Câu 3: Trong 1 mol phân tử FeCl3 có bao nhiêu gam nguyên tử clo?
A. 71,0 gam.
B. 35,5 gam.
C. 142,0 gam
D. 106,5 gam.
Câu 4: Có bao nhiêu mol nguyên tử O trong 1 mol phân tử N2O5?
A. 2 mol.
B. 4 mol.
C. 5 mol.
D. 3 mol.
Câu 5: Khối lượng của Fe trong 92,8 g Fe3O4 là
A. 25,6 g.
B. 67,2 g.
C. 80 g.
D. 10 g.
Câu 1: Thành phần phần trăm về khối lượng của nguyên tố Fe trong hợp chất Fe3O4 là:
A. 72,4%
B. 68,8%
C. 76%
D. 62,5%
Câu 2: Hợp chất X có khối lượng mol phân tử là 232 g/mol, thành phần phần trăm khối lượng của Fe là 72,41%, còn lại là của O. Công thức hóa học của X là
A. Fe3O4.
B. FeO.
C. Fe3O2.
D. Fe2O3.
Câu 3: Trong 1 mol phân tử FeCl3 có bao nhiêu gam nguyên tử clo?
A. 71,0 gam.
B. 35,5 gam.
C. 142,0 gam
D. 106,5 gam.
Câu 4: Có bao nhiêu mol nguyên tử O trong 1 mol phân tử N2O5?
A. 2 mol.
B. 4 mol.
C. 5 mol.
D. 3 mol.
Câu 5: Khối lượng của Fe trong 92,8 g Fe3O4 là
A. 25,6 g.
B. 67,2 g.
C. 80 g.
D. 10 g.
Đúng 1
Bình luận (0)
tìm thành phần phần trăm(theo khối lượng)các nguyên tố hoá học có trong những hợp chất sau:
a,CO và CO2 b,Fe3O4 và Fe2O3 c,SO2 vàSO3
a/
+ CO
%mC = \(\frac{12}{12+16}.100\%=42,86\%\)%mO = 100% - 42,86% =57,14%+CO2
%mC = \(\frac{12}{12+16.2}.100\%=27,27\%\) %mO = 100% - 27,27% = 72,73%b/
+Fe3O4
%mFe = \(\frac{56.3}{56.3+16.4}.100\%=72,41\%\) %mO = 100% - 72,41% = 27,59%+ Fe2O3
%mFe = \(\frac{56.2}{56.2+16.3}.100\%=70\%\) %mO = 100% - 70% = 30%c/
+SO2
%mS = \(\frac{32}{32+16.2}.100\%=50\%\)%mO = 100% - 50% = 50%+ SO3
%mS = \(\frac{32}{32+16.3}.100\%=40\%\) %mO = 100% - 40% = 60%
Đúng 1
Bình luận (0)
Xác định thành phần trăm theo khối lượng của các nguyên tố có trong hợp chất
D. Al2(SO4)3 biết ( Al : 27, S: 32, O : 16)
E. Fe3O4 biết ( Fe: 56, O: 16)
\(\left\{{}\begin{matrix}\%Al=\dfrac{27.2}{342}.100\%=15,79\%\\\%S=\dfrac{32.3}{342}.100\%=28,07\%\\\%O=\dfrac{16.12}{342}.100\%=56,14\end{matrix}\right.\)
\(\left\{{}\begin{matrix}\%Fe=\dfrac{56.3}{232}.100\%=72,414\%\\\%O=\dfrac{4.16}{232}.100\%=27,586\%\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Tìm thành phần phần trăm (theo khối lượng) các nguyên tố hóa học có trong những hợp chất sau:a) Fe3O4 và Fe2O3.b) SO2 và SO3.c. Một loại oxit đồng màu đen có khối lượng mol phân tử là 80g. Oxit này có thành phần là 80% Cu và 20% O. Hãy tìm công thức hóa học của loại oxit đồng nói trên.d. Hãy tìm công thức hóa học của khí A.- Khí A nặng hơn khí hiđro 17 lần.- Thành phần theo khối lượng của khí A là 5,88% H và 94,12% S.
Đọc tiếp
Tìm thành phần phần trăm (theo khối lượng) các nguyên tố hóa học có trong những hợp chất sau:
a) Fe3O4 và Fe2O3.
b) SO2 và SO3.
c. Một loại oxit đồng màu đen có khối lượng mol phân tử là 80g. Oxit này có thành phần là 80% Cu và 20% O. Hãy tìm công thức hóa học của loại oxit đồng nói trên.
d. Hãy tìm công thức hóa học của khí A.
- Khí A nặng hơn khí hiđro 17 lần.
- Thành phần theo khối lượng của khí A là 5,88% H và 94,12% S.
a) Với Fe3O4 thì Fe là 72,4% và O là 27,6%;
Với Fe2O3 thì Fe là 70% và O là 30%
b) Với SO2 thì S là 50% và O là 50%
Với SO3 thì S là 40% và O là 60%
c) mCu= \(\dfrac{80.80}{100}\)=64(g) ; mO=\(\dfrac{80.20}{100}\)=16(g)
nCu=\(\dfrac{64}{64}\)=1(mol) ; nO=\(\dfrac{16}{16}\)=1(mol)
Vậy CTHH của oxit đồng màu đen là: CuO
d) dA/H2=\(\dfrac{Ma}{2}\)=17 => MA=2.17=34(đvC)
H =\(\dfrac{5,88.34}{100}\)\(\approx\)2(đvC) ; S =\(\dfrac{94,12.34}{100}\)\(\approx\)32
=> CTHH của chất khí A là SH2
Đúng 0
Bình luận (0)
tìm CTHH của hợp chất, biết:a/ khối lượng mol của hợp chất A là 142 gam,thành phần phần trăm theo khối lượng của các nguyên tố: 32,39%Na;22,54%S;45,07%Ob/ khối lượng mol của hợp chất B là 123 gam, thành phần phần trăm theo khối lượng của các nguyên tố: 58,5%C;4,1%H;11,4%N;26%Oc/ hợp chất C có khối lượng mol nặng gấp 23 lần khí hidro, thành phần phần trăm theo khối lượng của các nguyên tố: 52,17%C; 13,05%H; 34,74%O
Đọc tiếp
tìm CTHH của hợp chất, biết:
a/ khối lượng mol của hợp chất A là 142 gam,thành phần phần trăm theo khối lượng của các nguyên tố: 32,39%Na;22,54%S;45,07%O
b/ khối lượng mol của hợp chất B là 123 gam, thành phần phần trăm theo khối lượng của các nguyên tố: 58,5%C;4,1%H;11,4%N;26%O
c/ hợp chất C có khối lượng mol nặng gấp 23 lần khí hidro, thành phần phần trăm theo khối lượng của các nguyên tố: 52,17%C; 13,05%H; 34,74%O
a)
-Đặt công thức: NaxSyOz
x=\(\dfrac{32,29.142}{23.100}\approx2\)
y=\(\dfrac{22,54.142}{32.100}\approx1\)
z=\(\dfrac{45,07.142}{16.100}\approx4\)
-CTHH: Na2SO4
Đúng 1
Bình luận (0)
Câu b này mình giải cách khác câu a:
nC:nH:nN:nO=\(\dfrac{\%C}{12}:\dfrac{\%H}{1}:\dfrac{\%N}{14}:\dfrac{\%O}{16}=\dfrac{58,5}{12}:\dfrac{4,1}{1}:\dfrac{11,4}{14}:\dfrac{26}{16}\)
nC:nH:nN:nO=4,875:4,1:0,81:1,625=6:5:1:2
-Công thức nguyên: (C6H5NO2)n
-Ta có: (12.6+5+14+16.2)n=123\(\Leftrightarrow\)123n=123\(\Leftrightarrow\)n=1
-CTHH: C6H5NO2
Đúng 1
Bình luận (0)
Câu c:
\(M_C=23.2=46đvC\)
nC:nH:nO=\(\dfrac{\%C}{12}:\dfrac{\%H}{1}:\dfrac{\%O}{16}=\dfrac{52,17}{12}:\dfrac{13,05}{1}:\dfrac{34,74}{16}\)
nC:nH:nO=4,3475:13,05:2,17125\(\approx\)2:6:1
-Công thức nguyên: (C2H6O)n
-Ta có: (12.2+6+16)n=46\(\Leftrightarrow\)46n=46\(\Leftrightarrow\)n=1
-CTHH: C2H6O
Đúng 1
Bình luận (0)
TÍNH THÀNH PHẦN PHẦN TRĂM THEO KHỐI LƯỢNG CỦA CÁC NGUYÊN TỐ CÓ CHỨA TRONG HỢP CHẤT K2SO4
Ta có: MK2SO4 = 39.2 + 32 + 16.4 = 174 (g/mol)
\(\Rightarrow\left\{{}\begin{matrix}\%K=\dfrac{39.2}{174}.100\%\approx44,8\%\\\%S=\dfrac{32}{174}.100\%\approx18,4\%\\\%O\approx36,8\%\end{matrix}\right.\)
Bạn tham khảo nhé!
Đúng 2
Bình luận (1)
Ta có: MK2SO4 = 39.2 + 32 + 16.4 = 174 (g/mol)
Đúng 1
Bình luận (0)
Xác định thành phần phần trăm theo khối lượng của các nguyên tố trong hợp chất khi biết công thức hoá học của hợp chất.Hợp chấtkhối lượng mình mol( M )Số mol nguyên tử của mỗi nguyên tố có trong 1 mol hợp chấtKhối lượng của mỗi nguyên tố có trong 1 mol hợp chấtThành phần phần trăm theo khối lượng của mỗi nguyên tố trong hợp chấtKMnO4 -Nêu các bước giải bài toán xác định thành phần phần trăm theo khối lượng của các nguyên tố trong hợp chất khi biết công thức hoá học của hợp chất ....
Đọc tiếp
Xác định thành phần phần trăm theo khối lượng của các nguyên tố trong hợp chất khi biết công thức hoá học của hợp chất.
| Hợp chất | khối lượng mình mol( M ) | Số mol nguyên tử của mỗi nguyên tố có trong 1 mol hợp chất | Khối lượng của mỗi nguyên tố có trong 1 mol hợp chất | Thành phần phần trăm theo khối lượng của mỗi nguyên tố trong hợp chất |
| KMnO4 |
-Nêu các bước giải bài toán xác định thành phần phần trăm theo khối lượng của các nguyên tố trong hợp chất khi biết công thức hoá học của hợp chất .
-Viết công thức tính thành phần phần trăm theo khối lượng của 1 nguyên tố trong hợp chất khi biết công thức hoá học của hợp chất.
Khối lượng mol :
MKMnO4 = 39 + 55 + 64 = 158 (g/mol)
Số mol nguyên tử của mỗi nguyên tố có trong 1 mol hợp chất :
nK = 1 mol
nMn = 1 mol
nO = 4 mol
Khối lượng của mỗi nguyên tố có trong 1 mol hợp chất :
mK = 39.1 = 39 (g)
mMn = 55.1 = 55 (g)
mO = 16.4 = 64 (g)
Thành phần phần trăm theo khối lượng của mỗi nguyên tố trong hợp chất :
\(\%m_K=\frac{m_K}{M_{KMnO_4}}.100\%=\frac{39}{158}.100\%=24,7\%\)
\(\%m_{Mn}=\frac{m_{Mn}}{M_{KMnO_4}}.100\%=\frac{55}{158}.100\%=34,8\%\)
\(\%m_O=\frac{m_O}{m_{KMnO_4}}.100\%=\frac{64}{158}.100\%=40,5\%\)
Đúng 0
Bình luận (5)
Các bước giải bài toán xác định thành phần phần trăm theo khối lượng của các nguyên tố trong hợp chất khi biết công thức hoá học của hợp chất :
B1 : Tính khối lượng mol (M) của hợp chất.
B2 : Tính số mol nguyên tử của mỗi nguyên tố có trong 1 mol hợp chất.
B3 : Tính khối lượng của mỗi nguyên tố có trong 1 mol hợp chất.
B4 : Tính thành phần phần trăm theo khối lượng của mỗi nguyên tố trong hợp chất.
Đúng 0
Bình luận (0)
Công thức tính thành phần phần trăm theo khối lượng của 1 nguyên tố trong hợp chất khi biết công thức hoá học của hợp chất :
\(\%m_A=\frac{m_A}{M_{h\text{/}c}}.100\%\)
Đúng 0
Bình luận (7)

























