Cho 8,9g hỗn hợp Zn và Mg vào 800ml dung dịch HCl1M. Cmr: sau pứ còn dư axit <giúp m vs ạ>

Những câu hỏi liên quan
Cho 8,9g hỗn hợp Zn và Mg tác dụng với 800ml dung dịch HCl 1M
chứng minh rằng sau PƯ axit vẫn còn dư
nHCl = 0,8.1 = 0,8
PTHH: Zn + 2HCl --> ZnCl2 + H2
Mg + 2HCl --> MgCl2 + H2O
Gọi số mol của Zn và Mg là a, b
=> 65a + 24b = 8,9
=> \(a=\dfrac{8,9-24b}{65}< \dfrac{8,9-24b}{24}\)
=> \(a< \dfrac{89}{240}-b\)
Theo PTHH, nHCl = 2a + 2b
=> \(n_{HCl}< 2.\left(\dfrac{89}{240}-b\right)+2b\)
=> \(n_{HCl}< \dfrac{89}{120}< 0,8\)
=> HCl dư sau phản ứng
Đúng 3
Bình luận (5)
Cho 11,3 gam hỗn hợp X gồm 2 kim loại Mg và Zn vào dung dịch chứa 36,5 gam axit clohiđric. Chứng minh rằng sau phản ứng axit còn dư?
Giả sử có \(11,3g\) Mg.
\(\Rightarrow n_{Mg}=\dfrac{11,3}{24}=0,471mol\)
\(n_{HCl}=\dfrac{m_{HCl}}{M_{HCl}}=\dfrac{36,5}{36,5}=1mol\)
\(\Rightarrow n_{Mg}< n_{HCl}\Rightarrow\)Sau phản ứng HCl còn dư.
Vậy sau phản ứng axit còn dư. (đpcm)
Đúng 2
Bình luận (0)
Hỗn hợp A gồm hai kim loại Mg và Zn. Dung dịch B là dung dịch HCl nồng độ a mol/l. Tiến hành 2 thí nghiệm:
Thí nghiệm 1: Cho 8,9g hỗn hợp A vào 2 lít dung dịch B, kết thúc phản ứng thu được 4,48lit H2 (dktc).
Thí nghiệm 2: Cho 8,9g hỗn hợp A vào 3 lít dung dịch B, kết thúc phản ứng cũng thu được 4,48lit H2 (đktc). Tính a
Xem chi tiết
PTPƯ 1:
\(Mg+2HCl->MgCl_2+H_2\)
0,1 0,2 0,1
\(Zn+2HCl->ZnCl_2+H_2\)
0,1 0,2 0,1
Gọi x, y là số mol của H2
Ta có hệ pt:
\(\left\{{}\begin{matrix}24x+65y=8,9\\22,4x+22,4y=4.48\end{matrix}\right.\)
\(=>x=y=0,1\left(mol\right)\)
\(M=\dfrac{n}{V}=\dfrac{0,2}{2}=0,1\left(M\right)\)
Pư 2 làm tg tự nha <3
Đúng 1
Bình luận (0)
hòa tan 8,9g hỗn hợp Mg,Zn vào lượng vừa đủ dung dịch H2SO4 0,2M thu được dung dịch A vaf4,48 lít khí H2 ở đktc
a)Tính thành phần % theo khối lượng của mỗi kim loại.
b)Tính V dung dịch axit đã dùng.
Cho 20,1 gam hỗn hợp A chứa Al, Mg, Al2O3 tác dụng với dung dịch NaOH dư thu được 6,72 lít H2 (đktc). Mặt khác, nếu hoà tan hết 20,1 gam A vào V lít dung dịch HCl1M thu được 15,68 lít H2 (đktc) và dung dịch B. Cần phải dùng hết 300ml dung dịch KOH 1M mới trung hoà hết lượng axit còn dư trong B. Khối lượng (gam) của Al2O3 trong A và giá trị của V lần lượt là: A. 5,4 và 1,7. B. 9,6 và 2,0. C. 10,2 và 1,7. D. 5,1 và 2,0
Đọc tiếp
Cho 20,1 gam hỗn hợp A chứa Al, Mg, Al2O3 tác dụng với dung dịch NaOH dư thu được 6,72 lít H2 (đktc). Mặt khác, nếu hoà tan hết 20,1 gam A vào V lít dung dịch HCl1M thu được 15,68 lít H2 (đktc) và dung dịch B. Cần phải dùng hết 300ml dung dịch KOH 1M mới trung hoà hết lượng axit còn dư trong B. Khối lượng (gam) của Al2O3 trong A và giá trị của V lần lượt là:
A. 5,4 và 1,7.
B. 9,6 và 2,0.
C. 10,2 và 1,7.
D. 5,1 và 2,0
Đáp án D
Khi hòa tan hỗn hợp vào dung dịch NaOH dư thì chỉ có Al và A12O3 bị hòa tan.
Khi đó 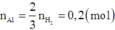
Khi hòa tan hỗn hợp vào dung dịch HCl (dư) thì cả ba chất trong hỗn hợp đều tan.
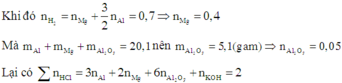
=> V = 2 (lít)
Đúng 0
Bình luận (0)
hòa tan 27,8g hỗn hợp Al, Fe,Zn(tỉ lệ mol tương ứng 1:1:3) trong 800ml dung dịch loãng HCl 0,375M, H2SO4 0,5625M. sau khi pứ kết thúc thu đc 1 dung dịch X
a) sau pứ kim loại hay axit còn dư? tính thể tích khí H2 sinh ra(đktc)
b) dung dịch X tác dụng tối da V(lít) dung dịch hỗn hợp chứa NaOH 0,4M, Ba(OH)2 0,2M. Tính V?
Cho 59,13 gam hỗn hợp X gồm Ca(HCO3)2 và Mg(HCO3)2 vào trong 350 ml dung dịch HCl 2M, đến khi pứ xảy ra htoan
a/ CM sau pứ muối cacbonat vẫn còn dư
b/ Tính thể tich CO2 thoát ra (đktc)
a/ Số mol HCl = 0,35 x 2 = 0,7 mol
Giả sử hỗn hợp chỉ có Ca(HCO3)2
=> nCa(HCO3)2 = 59,13 / 162 = 0,365 mol
PTHH: Ca(HCO3)2 + 2HCl ===> CaCl2 + 2CO2 + 2H2O
0,35.........0,7..............................................0,7
Vì nX = \(\frac{59,13}{\overline{M}}>0,365>0,35\)
=> Chắc chắn hỗn hợp muối X còn dư
b/ Vì HCl phản ứng hết nên số mol CO2 tính theo HCl
Theo PTHH: nCO2 = 0,7 mol
=> VCO2(đktc) = 0,7 x 22,4 = 15,68 lít
Đúng 0
Bình luận (0)
Câu 17: Cho 8,9g hỗn hợp Zn, Mg tan hoàn toàn trong H2SO4 đặc nóng thu được dung dịch X và 0,15 mol SO2 ; 0,01 mol S ; 0,005 mol H2S. Tính khối lượng của mỗi kim loại trong hỗn hợp?2 2. Hoà tan 37,1 g hh X gồm Fe, Zn, Cu trong dd H2SO4 đđ, nóng dư thu được dung dịch A và 15,68 lít khí SO2 (sản phẩm khử duy nhất). 37,1 g X tác dụng với dd HCl dư thì thu được 11,2 lít khí (đkc). Tính % khối lượng mỗi kim loại trong hh X.Câu 23. Cho 7,6 gr hỗn hợp gồm Fe, Mg, Cu vào dung dịch H2SO4 đ, nguội dư thì...
Đọc tiếp
Câu 17: Cho 8,9g hỗn hợp Zn, Mg tan hoàn toàn trong H2SO4 đặc nóng thu được dung dịch X và 0,15 mol SO2 ; 0,01 mol S ; 0,005 mol H2S. Tính khối lượng của mỗi kim loại trong hỗn hợp?
2 2. Hoà tan 37,1 g hh X gồm Fe, Zn, Cu trong dd H2SO4 đđ, nóng dư thu được dung dịch A và 15,68 lít khí SO2 (sản phẩm khử duy nhất). 37,1 g X tác dụng với dd HCl dư thì thu được 11,2 lít khí (đkc). Tính % khối lượng mỗi kim loại trong hh X.
Câu 23. Cho 7,6 gr hỗn hợp gồm Fe, Mg, Cu vào dung dịch H2SO4 đ, nguội dư thì thu được 3,08 lit khí SO2 (đkc). Phần không tan cho tác dụng với dung dịch HCl dư thu được 1,12 lit khí (đkc).Tính % khối lượng hỗn hợp đầu
cho 3,78g hỗn hợp a gồm mg và al vào dung dịch b chứa 0,25 mol hcl và 0,125 mol h2so4 ta thu đc dung dịch c và 4,368 lít h2 (đktc)
a)cm trong dung dịch axit vẫn còn dư
b) tính % mỗi kim loại trong hỗn hợp a
a. nH2=4,368/22,4=0,195
Mg+2HCl->MgCl2+H2
Mg+H2SO4->MgSO4+H2
2Al+6HCl->2AlCl3+3H2
2Al+3H2SO4->Al2(SO4)3+3H2
Theo phương trình nH2=nHCl/2+nH2SO4
Nếu axit hết
->nH2=nHCl/2+nH2SO4
->nH2=0,25/2+0,125=0,25>0,195
->Axit phải dư
b. Gọi số mol Mg và Al là a và b
Ta có 24a+27b=3,87
Theo pt : nH2=nMg+1,5nAl
->0,195=a+1,5b
->a=0,06; b=0,09
->%mMg=0,06.24/3,87=37,21%
->%mAl=62,79%
HT





















