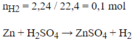Giúp mình
Bài 2 : Cho 10,5g hỗn hợp 2kim loại Cu,Zn vào dung dịch 500ml H2SO4 loãng dư,người ta thu được 2,24 lít khí (đktc).
a/ Viết phương trình hoá học.
b/Tính thành phần tram khối lượng mỗi kim loại trong hỗn hợp.
c/ Tính nồng độ mol dung dịch axit H2SO4.