Bài 2. Tính số mol của những lượng chất sau:
a, 13 gam Zn; 5,4 gam H2O ; 13,2 gam CO2
b, 0,6.1023 phân tử NaCl ; 12.1023 nguyên tử Ca.
Bài 1. Hoàn thành các PTHH sau và cho biết tỉ lệ số nguyên tử, số phân tử của các chất trong mỗi phản ứng:
a, K2O + H2O --> KOH
b, Cu + O2 --> CuO
c, Al2(SO4)3 + BaCl2 --> BaSO4 + AlCl3
Bài 2. Tính số mol của những lượng chất sau:
a, 13 gam Zn; 5,4 gam H2O ; 13,2 gam CO2
b, 0,6.1023 phân tử NaCl ; 12.1023 nguyên tử Ca.
Bài 3. Tính khối lượng của những lượng chất sau:
a, 0,5 mol H2SO4 ; 0,2 mol NaOH ; 0,1 mol Ag.
b*, Tính khối lượng của 15.1023 phân tử SO2
1.
a, K2O + H2O --> 2KOH (1:1:2)
b, 2Cu + O2 --> 2CuO (2:1:2)
c, Al2(SO4)3 + 3BaCl2 --> 3BaSO4 + 2AlCl3 (1:3:3:2)
Bài 2:
\(a,n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\\ n_{H_2O}=\dfrac{5,4}{18}=0,3\left(mol\right)\\ n_{CO_2}=\dfrac{13,2}{44}=0,3\left(mol\right)\\ b,n_{NaCl}=\dfrac{0,6.10^{23}}{6.10^{23}}=0,1\left(mol\right)\\ n_{Ca}=\dfrac{1,2.10^{23}}{6.10^{23}}=0,2\left(mol\right)\)
Bài 3:
\(a,m_{H_2SO_4}=0,5.98=49\left(g\right)\\ m_{NaOH}=0,2.40=8\left(g\right)\\ m_{Ag}=108.0,1=10,8\left(g\right)\\ b,n_{SO_2}=\dfrac{15.10^{23}}{6.10^{23}}=2,5\left(mol\right)\\ m_{SO_2}=64.2,5=160\left(g\right)\)
Bài 3. Tính khối lượng của những lượng chất sau:
a, 0,5 mol H2SO4 ; 0,2 mol NaOH ; 0,1 mol Ag.
b*, Tính khối lượng của 15.1023 phân tử SO2
a.
\(m_{H_2SO_4}=0.5\cdot98=49\left(g\right)\)
\(m_{NaOH}=0.2\cdot40=8\left(g\right)\)
\(m_{Ag}=0.1\cdot108=10.8\left(g\right)\)
b.
\(n_{SO_2}=\dfrac{15\cdot10^{23}}{6\cdot10^{23}}=2.5\left(mol\right)\)
\(m_{SO_2}=2.5\cdot64=160\left(g\right)\)
Bài 1: Tính khối lượng của các chất sau:
a. 0,25 mol CuO
b. 13,44 lít khí SO3 (đktc)
c. 1,2.1023 phân tử MgO
Bài 2: Tính khối thể tích (đktc) của các chất khí sau:
a. 0,3 mol CO2
b. 1,6 gam khí SO3
c. 0,3.1023 phân tử CO
Bài 3: Tính tỉ khối của các chất khí sau:
a. H2so với SO2
b. O2 so với không khí
Bài 4:Tính khối lượng mol của khí A, biết tỉ khối của khí O2 so với khí A bằng 1/2
Tính số mol, khối lượng, số ptu của các chất khí sau
a,1,12 lít O2
a, 2,24 lít SO3
c, ,36 lít H2S
d, 4,48 lít C4H10
Bài 2 Tính số mol , số phân tử các chất sau:
a, 16 gam SO3
b, 8 gam NaOH
c, 16 gam Fe2(SO4)3
d, 34,2 gam Al2(SO4)3
Bài 1 :
Số mol , khối lượng , số phân tử của các chất lần lượt là :
\(a.\)\(\)
\(n_{O_2}=\dfrac{1.12}{22.4}=0.05\left(mol\right)\)
\(m_{O_2}=0.05\cdot32=1.6\left(g\right)\)
\(0.05\cdot6\cdot10^{23}=0.3\cdot10^{23}\left(pt\right)\)
\(b.\)
\(n_{SO_3}=\dfrac{2.24}{22.4}=0.1\left(mol\right)\)
\(m_{SO_3}=0.1\cdot80=8\left(g\right)\)
\(0.1\cdot6\cdot10^{23}=0.6\cdot10^{23}\left(pt\right)\)
\(c.\)
\(n_{H_2S}=\dfrac{36}{22.4}=\dfrac{45}{28}\left(mol\right)\)
\(m_{H_2S}=\dfrac{45}{28}\cdot34=\dfrac{765}{14}\left(g\right)\)
\(\dfrac{45}{28}\cdot6\cdot10^{23}=\dfrac{135}{14}\cdot10^{23}\left(pt\right)\)
\(d.\)
\(n_{C_4H_{10}}=\dfrac{4.48}{22.4}=0.2\left(mol\right)\)
\(m_{C_4H_{10}}=0.2\cdot58=11.6\left(g\right)\)
\(0.2\cdot6\cdot10^{23}=1.2\cdot10^{23}\left(pt\right)\)
Bài 2 :
\(a.\)
\(n_{SO_3}=\dfrac{16}{80}=0.2\left(mol\right)\)
Số phân tử SO3 : \(0.2\cdot6\cdot10^{23}=1.2\cdot10^{23}\left(pt\right)\)
\(b.\)
\(n_{NaOH}=\dfrac{8}{40}=0.2\left(mol\right)\)
Số phân tử NaOH : \(0.2\cdot6\cdot10^{23}=1.2\cdot10^{23}\left(pt\right)\)
\(c.\)
\(n_{Fe_2\left(SO_4\right)_3}=\dfrac{16}{400}=0.04\left(mol\right)\)
Số phân tử Fe2(SO4)3 : \(0.04\cdot6\cdot10^{23}=0.24\cdot10^{23}\left(pt\right)\)
\(d.\)
\(n_{Al_2\left(SO_4\right)_3}=\dfrac{34.2}{342}=0.1\left(mol\right)\)
Số phân tử Al2(SO4)3 : \(0.1\cdot6\cdot10^{23}=0.6\cdot10^{23}\left(pt\right)\)
Bài 2 Tính số mol , số phân tử các chất sau:
a, 16 gam SO3
\(n_{SO_3}=\dfrac{16}{80}=0,2\left(mol\right)\)
b, 8 gam NaOH
\(n_{NaOH}=\dfrac{8}{40}=0,2\left(mol\right)\)
c, 16 gam Fe2(SO4)3
\(n_{Fe_2\left(SO_4\right)_3}=\dfrac{16}{400}=0,04\left(mol\right)\)
d, 34,2 gam Al2(SO4)3
\(n_{Al_2\left(SO_4\right)_3}=\dfrac{34,2}{342}=0,1\left(mol\right)\)
Bài 2. Tính số mol của những lượng chất sau:
4 gam khí Hidro, 8 gam CuSO4, 33,6 lit SO2 (ở đktc), 3,6.1023 nguyên tử Na.
Công thức:
Tính số mol khí khi biết thể tích khí ở điều kiện tiêu chuẩn: n = 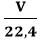
Tính thể tích khí ở điều kiện tiêu chuẩn khi biết số mol: V = n.22,4 (lít)
Trong đó:
+ n: số mol khí (mol)
+ V: thể tích khí ở đktc (lít) công thức
\(n_{H_2}=\dfrac{4}{2}=2\left(mol\right)\)
\(n_{CuSO_4}=\dfrac{8}{160}=0,05\left(mol\right)\)
\(n_{SO_2}=\dfrac{33,6}{22,4}=1,5\left(mol\right)\)
\(n_{Na}=\dfrac{3,6.10^{23}}{6.10^{23}}=0,6\left(mol\right)\)
3. Hãy cho biết số nguyên tử hoặc phân tử có trong những lượng chất sau:
a. 0,1mol nguyên tử H
b. 10 mol phân tử H2O
c. 0,25 mol phân tử CH4
4. Hãy xác định khối lượng mol của những lượng chất sau:
a. 1 mol phân tử CuO
b. 1 mol phân tử Fe2(SO4)3
c. N phân tử C2H2
5. Hợp chất đồng (II) sunfat có phân tử gồm 1Cu, 1S, 4O.
a. Tìm CTHH của hợp chất trên.
b. Tính khối lượng mol của phân tử trên.
c. Tính số mol nguyên tử đồng và nguyên tử oxi có trong 1mol phân tử đồng (II) sunfat.
Bài 3:
\(a,Số.nguyên.tử.H=0,1.6.10^{23}=6.10^{22}\) ( nguyên tử )
\(b,Số.phân.tử.H_2O=10.6.10^{23}=6.10^{24}\left(phân.tử\right)\)
\(c,Số.phân.tử.CH_4=0,25.6.10^{23}=1,5.10^{23}\left(phân.tử\right)\)
Bài 4:
a, \(M_{CuO}=64+16=80\left(\dfrac{g}{mol}\right)\)
\(b,M_{Fe_2\left(SO_4\right)_3}=56.2+32.3+16.12=400\left(\dfrac{g}{mol}\right)\)
\(c,M_{C_2H_2}=12.2+1.2=26\left(\dfrac{g}{mol}\right)\)
< Bài này bạn xem lại đề giúp mình nhé! Thấy nó cho ko hợp lí == >
Bài 5:
a, CTHH: CuSO4
b, \(M_{CuSO_4}=64+32+16.4=160\left(\dfrac{g}{mol}\right)\)
c, \(n_{Cu}=\dfrac{64}{64}=1mol\\ n_O=\dfrac{16.4}{16}=4mol\)
Câu 1 Tính số nguyên tử hoặc phân tử có trong những lượng chất sau:
a) 0, 5 mol nguyên tử O.
b) 1, 55 mol nguyên tử C.
Câu 2. Tính số mol nguyên tử hoặc mol phân tử trong những lượng chất sau:
a) 16, 428.1022 nguyên tử K.
b) 2, 505.1024 phân tử SO2.
Câu 3 Khi cho m gam kim loại Mg phản ứng với dung dịch hydrochloric acid dư thu được muối Magnesium chloric (MgCl2) và 6,958 lít khí hydrogen ở 250C, 1 bar. Tính m?
Nhanh giúp mình và viết rõ 1 tí ạ
Câu 1:
a) Để tính số nguyên tử trong 0,5 mol nguyên tử O, ta sử dụng công thức:
Số nguyên tử = số mol x số Avogadro
Số nguyên tử O = 0,5 mol x 6,022 x 10^23 nguyên tử/mol = 3,011 x 10^23 nguyên tử
b) Tương tự, để tính số nguyên tử trong 1,55 mol nguyên tử C:
Số nguyên tử C = 1,55 mol x 6,022 x 10^23 nguyên tử/mol = 9,331 x 10^23 nguyên tử
Câu 2:
a) Để tính số mol nguyên tử trong 16,428 x 10^22 nguyên tử K, ta sử dụng công thức:
Số mol = số nguyên tử / số Avogadro
Số mol K = 16,428 x 10^22 nguyên tử / 6,022 x 10^23 nguyên tử/mol = 0,0272 mol
b) Tương tự, để tính số mol phân tử trong 2,505 x 10^24 phân tử SO2:
Số mol SO2 = 2,505 x 10^24 phân tử / 6,022 x 10^23 phân tử/mol = 4,16 mol
Câu 3:
Để tính m, ta sử dụng phương trình phản ứng giữa Mg và HCl:
Mg + 2HCl -> MgCl2 + H2
Theo phương trình, ta thấy 1 mol Mg tạo ra 1 mol H2. Vì vậy, 6,958 lít H2 (ở điều kiện tiêu chuẩn) tương ứng với 1 mol H2.
Vậy, số mol H2 = 6,958 lít / 22,4 lít/mol = 0,31 mol
Do đó, số mol Mg cần để tạo ra 0,31 mol H2 là 0,31 mol.
Molar mass của Mg là 24,31 g/mol.
Vậy, m = số mol x molar mass = 0,31 mol x 24,31 g/mol = 7,53 g.
Câu 2:
Hãy tìm khối lượng và thể tích ở đktc của những lượng chất sau:
a)0,15 N phân tử O2
b) 1,44 . 1023 phân tử CO2
c) 0,25 mol khí H2
d) 1,5 mol CH4
e) 8,8 gam CO2
GIÚP MIK VỚI Ạ, MIK ĐAG CẦN GẤP.
\(a.\)
\(n_{O_2}=\dfrac{0.15\cdot N}{N}=0.15\left(mol\right)\)
\(m_{O_2}=0.15\cdot32=48\left(g\right)\)
\(V_{O_2}=0.15\cdot22.4=3.36\left(l\right)\)
\(b.\)
\(n_{CO_2}=\dfrac{1.44\cdot10^{23}}{6\cdot10^{23}}=0.24\left(mol\right)\)
\(m_{CO_2}=0.24\cdot44=10.56\left(g\right)\)
\(V_{CO_2}=0.24\cdot22.4=5.376\left(l\right)\)
\(c.\)
\(m_{H_2}=0.25\cdot2=0.5\left(g\right)\)
\(V_{H_2}=0.25\cdot22.4=5.6\left(l\right)\)
\(d.\)
\(m_{CH_4}=1.5\cdot16=24\left(g\right)\)
\(V_{CH_4}=1.5\cdot22.4=33.6\left(l\right)\)
\(e.\)
\(n_{CO_2}=\dfrac{8.8}{44}=0.2\left(mol\right)\)
\(V_{CO_2}=0.2\cdot22.4=4.48\left(l\right)\)
Câu 9. Tính khối lượng của những lượng chất sau:
a) 0,3 mol nguyên tử Na; 0,3 mol phân tử O2
b) 1,2 mol phân tử HNO3; 0,5 mol phân tử Cu
c) 0,125 mol của mỗi chất sau: KNO3, KMnO4, KClO3
Câu 9. Tính khối lượng của những lượng chất sau:
a) 0,3 mol nguyên tử Na;=>m Na=0,3.23=6,9g
0,3 mol phân tử O2=>m O2=0,3.32=9,6g
b) 1,2 mol phân tử HNO3; =>n HNO3=1,2.63=75,6g
0,5 mol phân tử Cu=>m Cu=0,5.64=32g
c) 0,125 mol của mỗi chất sau:
KNO3, KMnO4, KClO3
m KNO3=0,125.101=12,625g
m KMnO4==0,125.158=19,75g
m KClO3=0,125.122,5=15,3125g