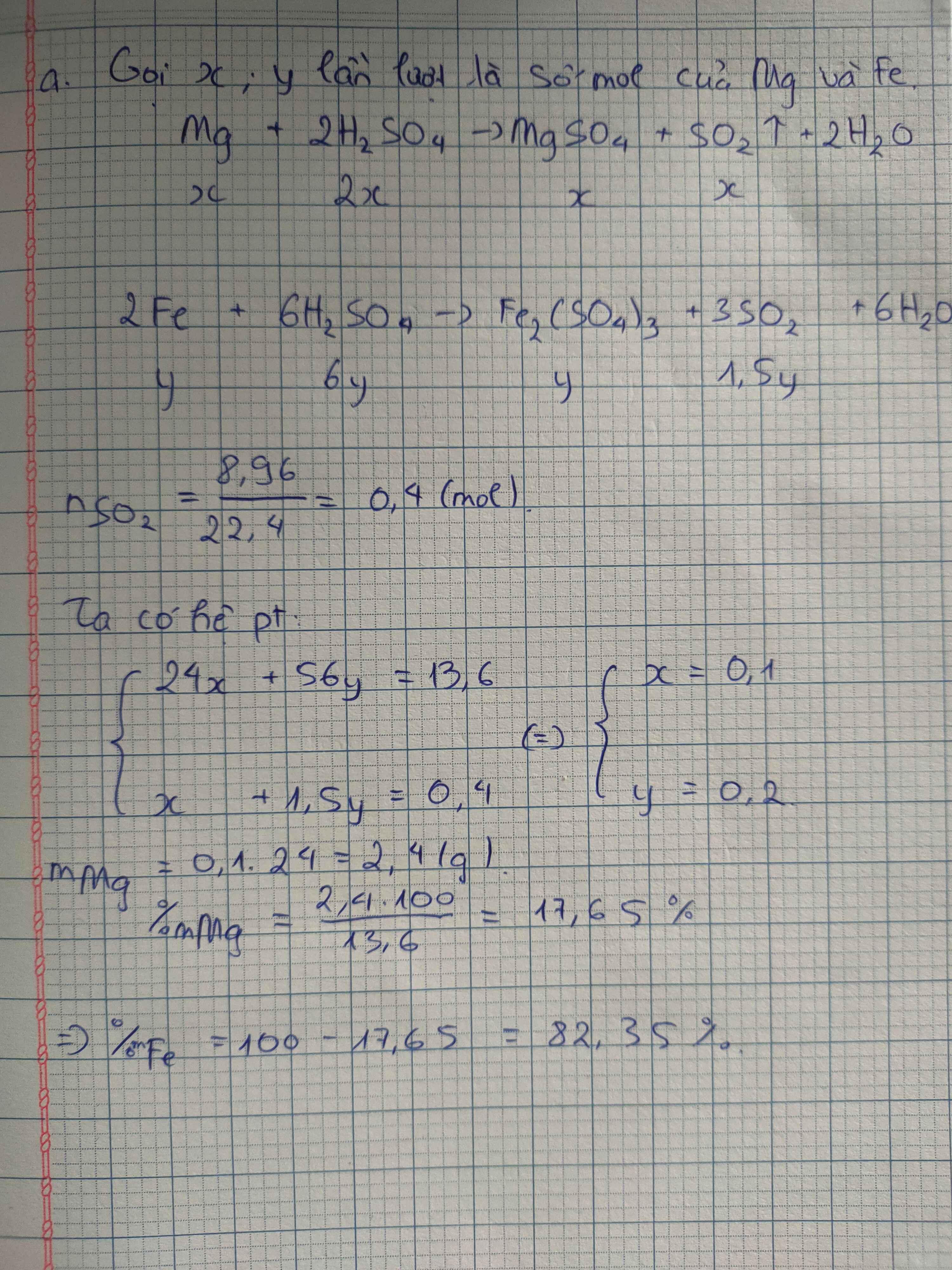Những câu hỏi liên quan
Hòa tan hoàn toàn 2.98g hỗn hợp X gồm Fe , Zn vào lượng dư chứa 500g dd H2so4 loãng thấy thoát ra 1.12 lít khí (đktc) và dd A. (a) tính phần trăm khối lượng mỗi kim loại trong hỗn hợp X (b) tính nồng độ % ban đầu của dd H2So4 biết rằng để trung hòa lượng ãit dư trong dd A cần 100ml dd KOH 1M . (c) tính nồng đọ % các chất có trong dd A
hòa tan hoàn toàn 13,9g hh gồm al và fe trong đd axit hcl 14,6% vừa đủ sau phản ứng thoát ra 7,84 l khí h2 ở đktc , thu đc dd X
a) vieeta pthh
b)tính khối lượng mỗi kim loại trong hh ban đầu
c) tính nồng độ phần trăm mỗi muối trong dd X
\(\text{Đặt }n_{Al}=x(mol);n_{Fe}=y(mol)\\ \Rightarrow 27x+56y=13,9(1)\\ n_{H_2}=\dfrac{7,84}{22,4}=0,35(mol)\\ a,PTHH:2Al+6HCl\to 2AlCl_3+3H_2(1)\\ Fe+2HCl\to FeCl_2+H_2(2)\\ b,\text{Từ 2 PT: }1,5x+y=0,35(2)\\ (1)(2)\Rightarrow x=0,1(mol);y=0,2(mol)\\ \Rightarrow m_{Al}=0,1.27=2,7(g)\\ m_{Fe}=0,2.56=11,2(g)\)
\(c,n_{HCl(1)}=3n_{Al}=0,3(mol);n_{AlCl_3}=0,1(mol);n_{H_2(1)}=0,15(mol)\\ \Rightarrow m_{dd_{HCl(1)}}=\dfrac{0,3.36,5}{14,6\%}=75(g)\\ \Rightarrow C\%_{AlCl_3}=\dfrac{0,1.133,5}{2,7+75-0,15.2}.100\%=17,25\%\)
\(n_{HCl(2)}=2n_{Fe}=0,4(mol);n_{FeCl_2}=n_{H_2(2)}=n_{Fe}=0,2(mol)\\ \Rightarrow m{dd_{HCl(2)}}=\dfrac{0,4.36,5}{14,6\%}=100(g)\\ \Rightarrow C\%_{FeCl_2}=\dfrac{0,2.127}{11,2+100-0,2.2}.100\%=22,92\%\)
Đúng 1
Bình luận (0)
a) 2Al + 6HCl --> 2AlCl3 + 3H2
Fe + 2HCl --> FeCl2 + H2
b) Gọi số mol Al, Fe lần lượt là a,b
=> 27a + 56b = 13,9
\(n_{H_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\)
2Al + 6HCl --> 2AlCl3 + 3H2
a----->3a--------->a------->1,5a______(mol)
Fe + 2HCl --> FeCl2 + H2
b------>2b-------->b----->b__________(mol)
=> 1,5a + b = 0,35
=> \(\left\{{}\begin{matrix}a=0,1=>m_{Al}=0,1.27=2,7\left(g\right)\\b=0,2=>m_{Fe}=0,2.56=11,2\left(g\right)\end{matrix}\right.\)
c) nHCl = 3a + 2b = 0,7 (mol)
=> mHCl = 0,7.36,5 = 25,55(g)
=> \(m_{ddHCl}=\dfrac{25,55.100}{14,6}=175\left(g\right)\)
\(m_{dd\left(saupu\right)}=13,9+175-2.0,35=188,2\left(g\right)\)
\(\left\{{}\begin{matrix}m_{AlCl_3}=0,1.133,5=13,35\left(g\right)\\m_{FeCl_2}=0,2.127=25,4\left(g\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}C\%\left(AlCl_3\right)=\dfrac{13,35}{188,2}.100\%=7,1\%\\C\%\left(FeCl_2\right)=\dfrac{25,4}{188,2}.100\%=13,5\%\end{matrix}\right.\)
Đúng 1
Bình luận (0)
1.Hòa tan 100g dd K2SO3 nồng độ 21,6% vào 200ml dd H2SO4(D=1,04g/ml)
a)Tính khối lượng chất dư sau phản ứng
b)Tính nồng độ % các chất tan sau phản ứng
2.Hóa tan hoàn toàn 11g hỗn hợp gồm Fe và Al bằng 1 lượng dd H2SO4 2M(vừa đủ) người ta thu được 8,96 lít khi ở đktc
a)Tính thành phần % khối lượng mỗi kim loại có trong hôn hợp
b)Tính VddH2SO4 đã dùng
thôi thì mình làm cho bn vậy, câu a ko làm dc đâu, làm câu b thôi, làm sao biết dc chất nào dư khi chỉ có số mol 1 chất?
nK2SO3=0.1367(mol)
mddH2SO4=Vdd.D=200.1,04=208(g)
K2SO3+H2SO4-->K2SO4+H2O+SO2
0.1367----0.1367----0.1367---------0.1367 (mol)
mddspu=100+208-0,1367.64=299.2512(g) ; mK2SO4=0,1367.174=23.7858(g)
==>C%=23.7858.100/299.512=7.94%
Đúng 0
Bình luận (3)
2)pt bn tự ghi nhé
ta có hệ pt: 56a+27b=11 và a+3b/2=8.96/22.4==>a=0.1, b=0.2
==>%Fe=0.1x56x100/11=50.9%
%Al=100%-50.9%=49.1%
b)nH2SO4= 0.7(mol)==>VddH2SO4=0.7/2=0.35(L)
Đúng 0
Bình luận (0)
bn xem lại đề nhé, bài 1mình thấy số mol ra lẻ><
Đúng 0
Bình luận (1)
Hoà tan hoàn toàn 20g hỗn hợp kim loại gồm Fe và Cu vào 100ml dd axit H2SO4 loãng vừa đủ sinh ra 4,48 lit khí đktc. Tính a. Thành phần % theo khối lượng mỗi kim loại trong hỗn hợp. b. nồng độ mol của dung dịch axit H2SO4 cần dùng.
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH:
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,2 0,2 0,2 0,2
\(a,\%m_{Fe}=\dfrac{0,2.56}{20}.100\%=56\%\)
\(\%m_{Cu}=100\%-56\%=44\%\)
\(b,C_{M\left(H_2SO_4\right)}=\dfrac{0,2}{0,1}=2\left(M\right)\)
Đúng 1
Bình luận (0)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(1\) \(1\) \(1\)
\(0,2\) \(0,2\) \(0,2\)
\(n_{H_2}=\dfrac{V}{22,4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
\(m_{Fe}=n.M=0,2.56=11,2\left(g\right)\)
\(^0/_0Fe=\dfrac{11,2}{20}.100^0/_0=56^0/_0\)
\(^0/_0Cu=100^0/_0-56^0/_0=44^0/_0\)
\(C_{M_{H_2SO_4}}=\dfrac{n}{V_{dd}}=\dfrac{0,2}{0,1}=2M\)
Đúng 1
Bình luận (0)
Hoà tan hoàn toàn 17,4g hỗn hợp Al,Fe, Cu trong dd H2SO4 19,6% loãng dư thu được 8,96l H2(đktc) và 6,4g rắn không tan
a)Tính % khối lượng các chất có trong hỗn hợp
b) Tính khối lượng dd H2SO4 19,6% cần dùng dư 10% so với lượng cần thiết
Hoà tan hoàn toàn 4,48g hỗn hợp x gồm FeO MgO và 200ml dd H2SO4. 0.45m lỏng vừa đủ thu đc dd y
a, Tính khối lượng vànthanhf phần phần trăm về khối lượng trong hỗn hợp x
b, Tính nồng độ mol các chất trong dd x ( giả sử Vdd không thay đổi và bằng Vdd axit
a, \(n_{H_2SO_4}=0,45.0,2=0,09\left(mol\right)\)
PTHH: FeO + H2SO4 → FeSO4 + H2O
Mol: a a
PTHH: MgO + H2SO4 → MgSO4 + H2O
Mol: b b
Ta có: \(\left\{{}\begin{matrix}72a+40b=4,48\\a+b=0,09\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,0275\\b=0,0625\end{matrix}\right.\)
\(\%m_{FeO}=\dfrac{0,0275.72.100\%}{4,48}=44,196\%\)
\(\%m_{MgO}=100-44,196=55,804\%\)
b,
PTHH: FeO + H2SO4 → FeSO4 + H2O
Mol: 0,0275 0,0275
PTHH: MgO + H2SO4 → MgSO4 + H2O
Mol: 0,0625 0,0625
\(C_{M_{ddFeSO_4}}=\dfrac{0,0275}{0,2}=0,1375M\)
\(C_{M_{ddMgSO_4}}=\dfrac{0,0625}{0,2}=0,3125M\)
Đúng 2
Bình luận (0)
Hoà tan hoàn toàn 13,6 gam hh A gồm Fe và Mg vào dd H2SO4 đặc, nóng 98% thu được dd X 8,96 lít khí SO2 (đktc).
a. Xác định thành phần % về khối lượng mỗi kim loại trong hỗn hợp ?
b. Tính nồng độ % các chất trong dd X .
#_giải chi tiết giùm nha mn_#
1.Hòa tan 100g dd K2SO3 nồng độ 21,6% vào 200ml dd H2SO4(D=1,04g/ml)
a)Tính khối lượng chất dư sau phản ứng
b)Tính nồng độ % các chất tan sau phản ứng
2.Hóa tan hoàn toàn 11g hỗn hợp gồm Fe và Al bằng 1 lượng dd H2SO4 2M(vừa đủ) người ta thu được 8,96 lít khi ở đktc
1.Hòa tan 100g dd K2SO3 nồng độ 21,6% vào 200ml dd H2SO4(D=1,04g/ml)
a)Tính khối lượng chất dư sau phản ứng
b)Tính nồng độ % các chất tan sau phản ứng
2.Hóa tan hoàn toàn 11g hỗn hợp gồm Fe và Al bằng 1 lượng dd H2SO4 2M(vừa đủ) người ta thu được 8,96 lít khi ở đktc