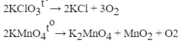Lấy cùng một lượng K C l O 3 và K M n O 4 để điều chế oxi. Chất nào tạo ra nhiều khí O 2 hơn. Nếu điều chế dùng một thể tích khí oxi thì dùng chất nào kinh tế hơn? Biết rằng giá K M n O 4 là 30.000 đ/kg và K C l O 3 là 96.000 đ/kg.

Những câu hỏi liên quan
Lấy cùng 1 lượng KMnO4;KClO3 để điều chế oxi thì chất nào cho nhiều oxi hơn?
+Muốn điều chế cùng 1 lượng oxi thì chất nào dùng kinh tế hơn?Biết giá thành KClO3 là 9600đ;KMnO4 là 30000đ
* Ta có PTHH:
2KMnO4 \(\rightarrow\) K2MnO4 + MnO2 + O2 (1)
2KClO3 \(\rightarrow\) 2KCl + 3O2 (2)
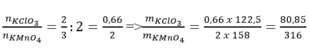
Gọi mKMnO4 = mKClO3 =a (g)
=> nKMnO4 = a/158 (mol) và nKClO3 = a/122.5 (mol)
Theo PT (1) => nO2 = 1/2 . nKMnO4 = 1/2 . a/158 = a/316 (mol)
Theo PT(2) => nO2 = 3/2 . nKClO3 = 3/2 . a/122.5 = 3/245 .a (mol)
Có : 1/316 < 3/245 => a/316 < 3/245 .a
hay nO2(PT1) < nO2(PT2)
=> KClO3 cho nhiều khí O2 hơn
TheO PT(2)
Đúng 0
Bình luận (1)
ý dưới tương tự nhé :
bạn đặt nO2(PT1) = nO2(PT2) =a
rồi tính mKMnO4 và mKClO3 theo a . Sau đó tính giá thành của 2 chất sau đó so sánh vs nhau thì sẽ biết chất nào dùng kinh tế hơn
Đúng 0
Bình luận (0)
Để điều chế oxi trong phòng thí nghiệm, người ta nung thuốc tím (KMnO4). Sau phản ứng, ngoài khí oxi còn thu được 2 chất rắn có công thức là K2MnO4 và MnO2.
a) Viết PTHH của phản ứng.
b) Tính khối lượng KMnO4 cần để điều chế 2,8l O2 (đktc) và khối lượng hai chất rắn sau phản ứng
a, PTPƯ:
2KMnO4 \(\underrightarrow{t^o}\) K2MnO4 + MnO2 + O2
b, nO2 = \(\dfrac{2,8}{22,4}\)= 0,125 mol
mKMnO4 = 2nO2 = 0,25 mol
=> mKMnO4 cần dùng = 0,25.158 = 39,5 g
nK2MnO4 = nMnO2 = nO2 = 0,125
=> mK2MnO4 = 0,125.197 = 24,625 g
=> mMnO2 = 0,125.87 = 10,875 g
Đúng 0
Bình luận (0)
Bài 1: lấy cùng một lượng KClO3 và KMnO4 để điều chế khí O2. Chất nào cho nhiều khí O2 hơn ?
Bài 2: Để oxi hóa hoàn toàn 5,4g nhôm :
a) Tính thể tích oxi cần dùng ?
b) Tính số gam KMnO4 cần dùng để điều chế lượng oxi trên ?
Bài 3: Đốt cháy 6,2g Photpho trong bình đựng 6,72 lít oxi ( ở đktc ) thu được điphotpho pentaoxit.
a) Chất nào dư ? Dư bao nhiêu mol ?
b) Tính khối lượng điphotpho pentaoxit thu được ?
Đọc tiếp
Bài 1: lấy cùng một lượng KClO3 và KMnO4 để điều chế khí O2. Chất nào cho nhiều khí O2 hơn ?
Bài 2: Để oxi hóa hoàn toàn 5,4g nhôm :
a) Tính thể tích oxi cần dùng ?
b) Tính số gam KMnO4 cần dùng để điều chế lượng oxi trên ?
Bài 3: Đốt cháy 6,2g Photpho trong bình đựng 6,72 lít oxi ( ở đktc ) thu được điphotpho pentaoxit.
a) Chất nào dư ? Dư bao nhiêu mol ?
b) Tính khối lượng điphotpho pentaoxit thu được ?
Bài 1: lấy cùng một lượng KClO3 và KMnO4 để điều chế khí O2. Chất nào cho nhiều khí O2 hơn ?
| 2KClO3 | → | 2KCl | + | 3O2 |
2KMnO4⟶MnO2+O2+K2MnO4
==>KClO3 THU ĐC NHIỀU KHÍ HƠNBài 2
4Al+3O2-->2Al2O3
0.2--0,15--------------mol
nAl=5,4 \27=0,2 mol
=>VO2=0,15.22,4=3,36 mol
2KMnO4⟶MnO2+O2+K2MnO4
0,4-------------------0,2 mol m=KMnO4=0,4.158 =63,2 mol4P+5O2=to=>2P2O5
nP=6,2\31=0,2(mol);nO2=6,72\22,4=0,3(mol
Theo PTHH, ta có: 0,24<0,35=>O2 dư
nO2(dư)=0,3−(0,2.54)=0,05(mol)
mO2(dư)=0,05.32=1,6(g)
nP2O5=24.nP=24.0,2=0,1(mol)
mP2O5=0,1.142=14,2(g)
Câu 1: Tính thể tích oxi thu được: Khi phân huỷ 9,8 gam kali clorat trong phòng thí nghiệm
Câu 2: Khi nung nóng kali pemanganat (KMnO4) tạo thành Kali manganat (K2MnO4), mangan đioxit và oxi.
a) Hãy viết PTHH của phản ứng
b) Tính khối lượng kali pemanganat cần lấy để điều chế được 33,6 lít khí oxi (đktc)
Câu 3: Nếu lấy 2 chất pemanganat (KMnO4) và Kali clorat (KClO3) với số mol bằng nhau để điều chế oxi. Chất nào cho thể tích oxi nhiều hơn.
Đọc tiếp
Câu 1: Tính thể tích oxi thu được: Khi phân huỷ 9,8 gam kali clorat trong phòng thí nghiệm
Câu 2: Khi nung nóng kali pemanganat (KMnO4) tạo thành Kali manganat (K2MnO4), mangan đioxit và oxi.
a) Hãy viết PTHH của phản ứng
b) Tính khối lượng kali pemanganat cần lấy để điều chế được 33,6 lít khí oxi (đktc)
Câu 3: Nếu lấy 2 chất pemanganat (KMnO4) và Kali clorat (KClO3) với số mol bằng nhau để điều chế oxi. Chất nào cho thể tích oxi nhiều hơn.
1.
\(2KClO_3\underrightarrow{^{to}}2KCl+3O_2\)
\(n_{KClO3}=\frac{9,8}{122,5}=0,08\left(mol\right)\)
\(\Rightarrow n_{O2}=\frac{3}{2}n_{KClO3}=\frac{3}{2}.0,08=0,12\left(mol\right)\)
\(\Rightarrow V_{O2}=0,12.22,4=2,688\left(l\right)\)
2.
\(a,2KMnO_4\underrightarrow{^{to}}K_2MnO_4+MnO_2+O_2\)
\(b,n_{O2}=\frac{33,6}{22,4}=1,5\left(mol\right)\)
\(\Rightarrow n_{KMnO4}=2n_{O2}=2.1,5=3\left(mol\right)\)
\(\Rightarrow m_{KMnO4}=3.158=474\left(g\right)\)
3.
\(2KMnO_4\underrightarrow{^{to}}K_2MnO_4+MnO_2+O_2\)
1____________________________0,5
\(2KClO_3\underrightarrow{^{to}}2KCl+3O_2\left(1\right)\)
1____________________1,5
Đặt \(n_{KMnO4}=n_{KClO3}=1\left(mol\right)\)
\(V_{O2\left(1\right)}=0,5.22,4=11,2\left(l\right)\)
\(V_{O2\left(2\right)}=1,5.22,4=33,6\left(l\right)\)
Vậy nung KClO3 sẽ cho thể tích oxi nhiều hơn.
Bài 1
a) Trong những chất sau đây những chất nào dùng để điều chế khí O2?CuSO4 ,KClO3,CaCo3,KMNO4,H2O,K2SO4,HgO
b) Tất cả các p.ứ điều chế O2 có thể gọi là điều chế phân hủy được không?
Bài 2:a)Tính thể tích oxi thu được ở đktc khi phân hủy 13,02g HgO?
b) Khí Oxi thu được có đủ để đốt cháy 0,48g bột nhôm
Đọc tiếp
Bài 1
a) Trong những chất sau đây những chất nào dùng để điều chế khí O2?CuSO4 ,KClO3,CaCo3,KMNO4,H2O,K2SO4,HgO
b) Tất cả các p.ứ điều chế O2 có thể gọi là điều chế phân hủy được không?
Bài 2:a)Tính thể tích oxi thu được ở đktc khi phân hủy 13,02g HgO?
b) Khí Oxi thu được có đủ để đốt cháy 0,48g bột nhôm
1.
a) Những chất được dùng để điều chế oxi trong phòng thí nghiệm là: KClO3, KMnO4.
b) tất cả phản ứng điều chế oxi được coi là phản ứng phân hủy
2.
a) 2HgO –nhiệt độ 2Hg + O2↑
Số mol HgO= 13.02/217=0.06
theo PTHH số mol O2= 0.06/2= 0.03
thể tích O2 ở đktc là : 0.03*22.4= 0.672 lít
Đúng 0
Bình luận (1)
Bài 3:
Đốt cháy 7,2
g kim loại magiê trong lọ chứa
khí oxi(đktc)
, tạo thành magiê oxit
a. Tính kh
ối lượng
m
agiê
oxit tạo thành
?
c. Trong phòng thí nghiệm để có lượng oxi đốt cháy hết 7,2g magiê trên, người ta phải
nung bao nhiêu gam thuốc tím(KMnO
4
). Biết PTHH điều chế khí oxi là
:
2KMnO
4
t
°
K
2
MnO
4
+ MnO
2
+ O
2
Xem chi tiết
Bài 3
\(2Mg+O2-->2MgO\)
\(n_{Mg}=\frac{7,2}{24}=0,3\left(mol\right)\)
\(n_{MgO}=n_{Mg}=0,3\left(mol\right)\)
\(m_{MgO}=0,3.40=12\left(g\right)\)
câu a rồi đến câu c hả
\(n_{O2}=\frac{1}{2}n_{Mg}=0,15\left(mol\right)\)
\(2KMnO4-->K2MnO4+MnO2+O2\)
\(n_{KMnO4}=2n_{O2}=0,3\left(mol\right)\)
\(m_{KMnO4}=0,3.158=47,4\left(g\right)\)
2Mg+O2--->2MgO
0,3----0,15---0,3 mol
nMg=7,2\24=0,3 mol
=>mMgO=0,3.40=12 g
2KMnO4-->K2MnO4+MnO2+O2
0,3-----------------------------------0,15 mol
=>mKMnO4=0,3.158=47,4 g
2Mg+O2--->2MgO
0,3----0,15---0,3 mol
nMg=7,2\24=0,3 mol
=>mMgO=0,3.40=12 g
2KMnO4-->K2MnO4+MnO2+O2
0,3-----------------------------------0,15 mol
=>mKMnO4=0,15.158=23,7 g
a) lấy cùng một lượng KCLO3 và Kmno4 để điều chế khí O2. Chất nào cho nhiều khí O2.
b) nếu điều chế cùng một thể tích khí oxi thì dùng chất nào kinh tế hơn? Biết giá KCLO3 là 96.000₫/kg và Kmno4 là 30.000₫/kg
Gọi m KClO3 và m KMnO4=a
-->n KClO3=a/122,4
n KMnO4=a/158(mol)
2KClO3--->2KCl+3O2
a/122,5------------>a/81,667(mol)
2KMnO4---->K2MnO4+MnO2+O2
a/158--------------------------------a/316(mol)
\(\frac{a}{81,667}>\frac{a}{316}\)
-->KClO3 cho nhiều khí hơn
b)

- giả sử lấy 1 mol KClO3 và 1 mol KMnO4
PTHH: 2 KClO3 -to-> 2 KCl + 3 O2
1_________________1_______1,5(mol)
2 KMnO4 -to-> K2MnO4 + MnO2 + O2
1____________0,5__________0,5__0,5(mol)
Vì 1,5 > 0,5 => Nếu cùng 1 lượng KClO3 và KMnO4 thì lượng O2 điều chết từ KClO3 sẽ nhiều hơn.
b)
PTHH: 2 KClO3 -to-> 2 KCl + 3 O2
2/3_________________2/3_______1(mol)
2 KMnO4 -to-> K2MnO4 + MnO2 + O2
2____________1__________1__1(mol)
Ví dụ cùng 1 mol O2.
Ta có , số tiền mua KMnO4= 30 000 . (316/1000)=9480 (đồng)
số tiền mua KClO3= 96000.((245/3) /1000)= 7840(đồng)
Vì 9480>7840 nên nếu cùng 1 thể tích O2 thì dùng KMnO4 kinh tế hơn.
trong phòng thí nghiệm người ta điều chế oxit sắt từ ( F3O4 ) bằng cách cho sắt kim loại tác dụng với oxi ở nhiệt độ cao .
a ) Tính số mol sắt và số mol oxi cần dùng để điều chế 4,64 gam F3O4
b) Tính số mol và số gam KMNO4 cần dùng để điều chế được lượng oxi cần dùng cho phản ứng oxi hóa sắt ở trên . Biết phản ứng : 2KMnO4➝ K2MnO4 + MnO2 +O2
Đọc tiếp
trong phòng thí nghiệm người ta điều chế oxit sắt từ ( F3O4 ) bằng cách cho sắt kim loại tác dụng với oxi ở nhiệt độ cao .
a ) Tính số mol sắt và số mol oxi cần dùng để điều chế 4,64 gam F3O4
b) Tính số mol và số gam KMNO4 cần dùng để điều chế được lượng oxi cần dùng cho phản ứng oxi hóa sắt ở trên . Biết phản ứng : 2KMnO4➝ K2MnO4 + MnO2 +O2
a, \(3Fe+2O_2\underrightarrow{^{to}}Fe_3O_4\)
\(n_{Fe3O4}=\frac{4,64}{232}=0,02\left(mol\right)\)
\(\rightarrow n_{Fe}=3n_{Fe3O4}=0,06\left(mol\right)\)
\(n_{O2}=2n_{Fe3O4}=0,04\left(mol\right)\)
b,\(PTHH:2KMnO_4\underrightarrow{^{to}}KMnO_2+MnO_2+O_2\)
\(n_{KMnO4}=2n_{O2}=0,08\left(mol\right)\)
\(\rightarrow m_{KMnO4O}=0,08.158=12,64\left(g\right)\)
Đốt cháy hoàn toàn 3,36g sắt trong oxi
A,lấy cùng một lượng để điều chế oxi Nếu điều chế cùng một thể tích khí oxi thì dùng chất nào có lợi hơn ?biết rằng kmno4 là 60000dong /1kg va kclo3 là 101000 dong /1kg? Viết Phương trình va giải thích.Cảm ơn mọi ngừoi
nFe = \(\frac{3,36}{56}=0,06\) mol
Pt: 3Fe + ...2O2 --to--> Fe3O4
0,06mol-> 0,04 mol
.....2KMnO4 --to--> K2MnO4 + MnO2 + O2
.....0,08 mol<---------------------------------0,04 mol
mKMnO4 = 0,08 . 158 = 12,64 (g)
Ta có: 1kg KMnO4 thì cần 60 000 đồng
Vậy: 12,64g--------------> 758 400 đồng
Pt: 2KClO3 --to--> 3KCl + 3O2
....0,03 mol<----------------0,04 mol
mKClO3 = 0,03 . 122,5 = 3,675 (g)
Ta lại có: 1kg KClO3 cần 101 000 đồng
Vậy: .......3,675g --------->371 175 đồng
Vậy nên dùng KClO3 thì lợi hơn
Đúng 0
Bình luận (1)
Xác định tỷ lệ theo khối lượng của K C l O 3 và K M n O 4 cần để điều chế một lượng O 2 như nhau với cùng hiệu suất (K = 39, Cl = 35,5, Mn = 55, O = 16).