Hoàn thành những phản ứng hóa học sau:
K C l O 3 → t 0
Cho biết mỗi phản ứng trên thuộc loại phản ứng hóa học nào?
Hoàn thành những phản ứng hóa học sau:
. . . + . . . → M g O
Cho biết mỗi phản ứng trên thuộc loại phản ứng hóa học nào?
Hoàn thành những phản ứng hóa học sau:
. . . + . . . → P 2 O 5
Cho biết mỗi phản ứng trên thuộc loại phản ứng hóa học nào?
4 P + 5 O 2 → 2 P 2 O 5
(Phản ứng hoá hợp)
Hoàn thành những phản ứng hóa học sau:
. . . + . . . → A l 2 O 3
Cho biết mỗi phản ứng trên thuộc loại phản ứng hóa học nào?
4 A l + 3 O 2 → A l 2 O 3
(phản ứng hoá hợp)
Hoàn thành những phản ứng hóa học sau:
H 2 O → d p
Cho biết mỗi phản ứng trên thuộc loại phản ứng hóa học nào?
H 2 O → d p 2 H 2 + O 2
(phản ứng phân huỷ)
Hoàn thành PT phản ứng hóa học sau và cho biết những phản ứng nào là phản ứng õi hóa khử
a) Mg+CO2--------> MgO+C
b) Fe3O4+CO--------> Fe+CO2
c) FexOy+Al---------> Fe+Al2O3
d) KMnO4----------> K2MnO4+MnO2+O2
a) 2Mg + CO2 -----------> 2MgO + C .Đây là phản ứng oxi hóa khử
b) 2Fe3O4 +8CO--------->6Fe +8CO2 .Đây là phản ứng oxi hóa khử
c) 3FexOy + 2yAl ----------->3xFe +yAl2O3 .Đây là phản ứng oxi hóa khử
d) 2KMnO4 ------------> K2MnO4 + MnO2 + O2. Đây là phản ứng oxi hóa khử
Cho biết phản ứng thuận nghịch sau:
2NaHCO3(r ) → Na2CO3 (r) + CO2 (k) + H2O (k), ΔH > 0
Có thể dùng những biện pháp gì để chuyển hóa nhanh và hoàn toàn NaHCO3 thành Na2CO3
Hãy hoàn thành các PTHH sau, cho biết những phản ứng sau đây tuộc loại phản ứng hóa học nào
a) Mg + O2 --->.....
b) 2H2 + O2 --->.....
c) FeO + H2 --->.....+.....
d) 2KClO3 --->.....+.....
f) Zn + HCl --->.....+....
a)
2Mg + O2 -to-> 2MgO => Hóa hợp
b)
2H2 + O2 -to-> 2H2O => Hóa hợp
c)
FeO + H2 -to-> Fe + H2O => Thế
d)
2KClO3 -to-> 2KCl + 3O2 => Phân hủy
f)
Zn + 2HCl => ZnCl2 + H2 => Thế
Có những sơ đồ phản ứng hóa học sau:
a) Cl2 + H2O → HCl + HClO
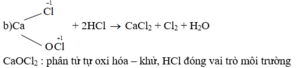
b) CaOCl2 + 2HCl → CaCl2 + Cl2 + H2O
c) Cl2 + KOH → KCl + KClO3 + H2O
d) HCl + KClO3 → KCl + Cl2 + H2O
e) NaClO + CO2 + H2O → NaHCO3 + HClO
f) CaOCl3 → CaCl2 + O2
Cho biết những phản ứng nào là phản ứng oxi hóa – khử? Vai trò các chất tham gia phản ứng oxi hóa – khử. Hoàn thành phương trình hóa học của các phản ứng.
Những phản ứng sau là phản ứng oxi hóa – khử:


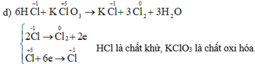
![]()
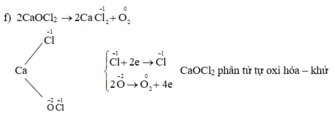
Hoàn thành các phản ứng hóa học sau và cho biết phản ứng nào là phản ứng hóa hợp , phản ứng cháy , phản ứng phân hủy , phản ứng thế.
a/.........+.........------> ZnO
b/.........+........-------> H³PO⁴
c/......+........-------> CO² + H²O
d/......+........------> K²S
e/H²O ----->......+........
f/KClO³ ------> ......+.......
g/.......+.......----> CuCl²
h/KMnO⁴ ------> ........+.......+.....
i/Zn +HCl -------> ......+......
j/Al + H²SO⁴ ------> .......+........
k/H² +......------> O² +.....
l/CaO + H²O ------> ...........
\(a/2Zn+O_2\xrightarrow[t^0]{}2ZnO\\ b/P_2O_5+3H_2O\xrightarrow[]{}2H_3PO_4\left(pư.hoá.hợp\right)\\ c/C_2H_4+3O_2\xrightarrow[t^0]{}2CO_2+2H_2O\left(pư.thế\right)\\ d/2K+S\xrightarrow[]{}K_2S\left(pư.hoá.hợp\right)\\ e/2H_2O\xrightarrow[đp]{}2H_2+O_2\left(pư.phân.huỷ\right)\\ f/2KClO_3\xrightarrow[t^0]{}2KCl+3O_2\left(pư.phân.huỷ\right)\\ g/Cu+Cl_2\xrightarrow[]{}CuCl_2\left(pư.hoá.hợp\right)\\ h/2KMnO_4\xrightarrow[t^0]{}K_2MnO_4+MnO_2+O_2\left(pư.phân.huỷ\right)\\ i/Zn+2HCl\xrightarrow[]{}ZnCl_2+H_2\left(pư.thế\right)\\ j/2Al+3H_2SO_4\xrightarrow[]{}Al_2\left(SO_4\right)_3+3H_2\left(pư.thế\right)\\ k/Sai.đề\\ l/CaO+H_2O\xrightarrow[]{}Ca\left(OH\right)_2\left(pư.hoá.hợp\right)\)