Khi cho 9,6 gam Mg tác dụng hết với dung dịch H 2 S O 4 thì có 49 gam H 2 S O 4 tham gia phản ứng, tạo ra một sản phẩm khử X. Chất X là
A. S O 2
B. S
C. H 2
D. H 2 S
Khi cho 9,6 gam Mg tác dụng hết với dung dịch H2SO4 đậm đặc, thấy có 49 gam H2SO4 tham gia phản ứng, tạo muối MgSO4, H2O và sản phẩm X. X là?
Khi cho 9,6 gam Mg tác dụng hết với dung dịch H2SO4 đậm đặc, thấy có 49 gam H2SO4 tham gia phản ứng, tạo muối MgSO4, H2O và sản phẩm khử X. X là:
A. SO2.
B. S.
C. H2S.
D. SO2, H2S.
Đáp án C:
Dung dịch H2SO4đậm đặc vừa là chất oxi hóa vừa là môi trường.
Gọi a là số oxi hóa của S trong X.
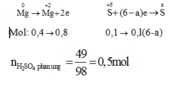
có 
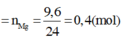
![]()
Áp dụng định luật bảo toàn mol electron, ta có:
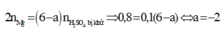
Do đó X là H2S
Khi cho 9,6 gam Mg tác dụng hết với dung dịch H2SO4 đậm đặc, thấy có 49 gam H2SO4 tham gia phản ứng, tạo muối MgSO4, H2O và sản phẩm khử X. X là :
A. SO2.
B. S.
C. H2S.
D. SO2, H2S.
Khi cho 9,6 gam Mg tác dụng hết với dung dịch H2SO4 đậm đặc, thấy có 49 gam H2SO4 tham gia phản ứng, tạo muối MgSO4, H2O và sản phẩm khử X. X là?
A. SO2
B. S
C. H2S
D. SO2, H2S
nMgSO4 = nMg = 0,4
nH2SO4 ban đầu = 0,5
Bảo toàn nguyên tố S ⇒ nS/khí = nH2SO4 – nMgSO4 = 0,1 mol
Cho e:
Mg0 → Mg2+ + 2e
0,4 → 0,8 (mol)
Nhận e:
S+6 + k(e) → Sx
0,02k ← 0,02 (mol)
Áp dụng định luật bảo toàn e có: 0,1k = 0,8 ⇒ k =8
k= 8 ⇒ x= -2 ⇒ Khí đó là H2S
Đáp án C.
cho 26,92 g hỗn hợp A gồm Mg Al Fe tác dụng vừa hết với 160 gam dung dịch H2 SO4 98% thu được dung dịch B chứa m gam muối sunfat 9,6 gam S và V lít khí SO2.giá trị của m là
Ta có: \(m_{H_2SO_4}=160.98\%=156,8\left(g\right)\Rightarrow n_{H_2SO_4}=\dfrac{156,8}{98}=1,6\left(mol\right)\)
\(n_S=\dfrac{9,6}{32}=0,3\left(mol\right)\)
\(4H_2SO_4+6e\rightarrow3SO_4^{2-}+S+4H_2O\)
1,2_______________0,9___0,3 (mol)
\(2H_2SO_4+2e\rightarrow SO_4^{2-}+SO_2+2H_2O\)
0,4______________0,2_____0,2 (mol)
⇒ m muối = mA + mSO42- = 26,92 + (0,9 + 0,2).96 = 132,52 (g)
Khi cho 9,6 gam Mg tác dụng hết với dung dịch H2SO4 đậm đặc, thấy có 49 gam H2SO4 tham gia phản ứng, tạo muối MgSO4, H2O và sản phẩm X. X là?
nMg=\(\frac{9,6}{24}\)=0,4 mol
\(\text{Mg=Mg+2 +2e}\)
\(\rightarrow\) n e nhường= 0,8 mol
nH2SO4=\(\frac{49}{98}\)=0,5 mol
BTNT, nMg=nMgSO4=0,4 mol
\(\rightarrow\) 0,4 mol H2SO4 tạo muối; 0,1 mol H2SO4 là chất oxh
\(\text{S+6 +(6-x)e =S+x }\)
nS+6 (OXH)= 0,1\(\rightarrow\) n e nhận= 0,1(6-x) mol
\(\rightarrow\) Ta có pt \(\text{0,1(6-x)=0,8 }\)
\(\rightarrow\) \(\text{x=-2}\)
\(\rightarrow\) Khí X là H2S (S có số OXH -2)
A là hỗn hợp gồm: Ba, Al, Mg.
Lấy m gam A cho tác dụng với nước tới khi hết phản ứng thấy thoát ra 3,36 lit H2 (đktc).
Lấy m gam A cho vào dung dịch xút dư tới khi hết phản ứng thấy thoát ra 6,72 lít H2 (đktc). Lấy m gam A hoà tan bằng một lượng vừa đủ dung dịch axit HCl thì thu được một dung dịch và 8,96 lit H2 (đktc).
TN1: A tác dụng với nước
Ba +2 H2O --> Ba(OH)2 + H2;
x ------------------x------------x ;
2Al + Ba(OH)2 +2 H2O --> Ba(AlO2)2 +3 H2;
2x--------x---------------------------------------3x;
TN2 : A tác dụng với dd xút
Ba +2 H2O --> Ba(OH)2 + H2;
x----------------------------------x;
2Al + Ba(OH)2 +2 H2O --> Ba(AlO2)2 +3 H2;
y-------------------------------------------------3/2y;
TN3: A tác dụng với HCl
Ba + 2HCl --> BaCl2 + H2;
x------------------------------x;
2Al + 6HCl --> 2AlCl3 + 3H2;
y------------------------------3/2y;
Mg + 2HCl --> MgCl2 + H2;
z------------------------------z;
Gọi x,y,z lần lượt là số mol của Ba, Al, Mg.
TN1: nH2= 3,36/22,4= 0,15 (mol)
=>x + 3x= 4x=0,15 => x= 0,0375 (mol)
TN2: nH2= 0,3 (mol)
=> x + 3/2 y = 0,3 => y = 0,175 (mol)
TN3: nH2= 0,4 (mol)
=> x +3/2y + z = 0,4 => Z= 0,1 (mol)
m= 0,0375*137+ 0,175*27+ 0,1*24=26,2625(g).
Cho 12 gam Mg tác dụng hết với dung dịch H 2 SO 4 98% (đặc) thì thu được 2,8 (đktc) lít khí X
(là sản phẩm khử duy nhất).
a. Tìm X.
b. Tìm khối lượng H 2 SO 4 98% đã dùng (biết lấy dư 50% so với lượng phản ứng). Tìm nồng độ
% của dung dịch mới.
a)
$n_{Mg} = \dfrac{12}{24} = 0,5(mol)$
$n_X = \dfrac{2,8}{22,4} = 0,125(mol)$
Gọi n là số electron nhận của X.
Bảo toàn electron : $2n_{Mg} = n.n_X$
$\Rightarrow n = \dfrac{0,5.2}{0,125} = 8$
Vậy X là $H_2S$
b) $n_{MgSO_4} = n_{Mg} = 0,5(mol)$
$n_{H_2SO_4} = n_{MgSO_4} + n_{H_2S} = 0,625(mol)$
$n_{H_2SO_4\ dư} = 0,625.50\% = 0,3125(mol)$
$n_{H_2SO_4\ đã\ dùng} = 0,625 + 0,3125 = 0,9375(mol)$
$m_{dd\ H_2SO_4} = \dfrac{0,9375.98}{98\%} = 93,75(gam)$
$m_{dd\ sau\ pư} = 12 + 93,75 - 0,125.34 = 101,5(gam)$
$C\%_{MgSO_4} = \dfrac{0,5.120}{101,5}.100\% = 59,11\%$
Cho 21,6 gam hỗn hợp bột Mg và Fe tác dụng hết với dung dịch HCl thấy có 11,2 lít khí H 2 thoát ra (đktc). Lượng muối clorua tạo ra trong dung dịch là
A. 39,4 gam.
B. 53,9 gam.
C. 58,1 gam.
D. 57,1 gam.