Cho một lượng kim loại R hoá trị n tác dụng với dung dịch H 2 SO 4 loãng rồi cô cạn dung dịch sau phản ứng thu được một lượng muối khan có khối lượng gấp 5 lần khối lượng kim loại R ban đầu đem hoà tan. Xác định kim loại R.

Những câu hỏi liên quan
Khử hoàn toàn m gam Fe2O3 ở nhiệt độ cao bằng khí CO, lượng Fe thu được sau phản ứng cho tác dụng hoàn toàn với dung dịch axit HCl. Nếu dùng lượng khí H2 vừa thu được để khử oxit của một kim loại R (hoá trị II) thành kim loại thì khối lượng oxit bị khử cũng bằng m gam.a. Viết các phương trình hoá học.b. Tìm công thức hóa học của oxit
Đọc tiếp
Khử hoàn toàn m gam Fe2O3 ở nhiệt độ cao bằng khí CO, lượng Fe thu được sau phản ứng cho tác dụng hoàn toàn với dung dịch axit HCl. Nếu dùng lượng khí H2 vừa thu được để khử oxit của một kim loại R (hoá trị II) thành kim loại thì khối lượng oxit bị khử cũng bằng m gam.
a. Viết các phương trình hoá học.
b. Tìm công thức hóa học của oxit
a)
$Fe_2O_3 + 3CO \xrightarrow{t^o} 2Fe +3 CO_2$
$Fe + 2HCl \to FeCl_2 + H_2$
$RO + H_2 \xrightarrow{t^o} R + H_2O$
b)
Coi m = 160(gam)$
Suy ra: $n_{Fe_2O_3} = 1(mol)$
Theo PTHH :
$n_{RO} = n_{H_2} = n_{Fe} = 2n_{Fe_2O_3} = 2(mol)$
$M_{RO} = R + 16 = \dfrac{160}{2} = 80 \Rightarrow R = 64(Cu)$
Vậy oxit là CuO
Đúng 3
Bình luận (2)
cho 20g oxit của kim loại M hoá trị 2 tác dụng hết với 700ml dung dịch H2SO4 1M. Sau đó trung hoà lượng axit dư cần dùng 400ml dung dịch NaOH 1M
Gọi số mol MO là x (mol)
\(n_{H_2SO_4}=0,7.1=0,7\left(mol\right)\)
\(n_{NaOH}=0,4.1=0,4\left(mol\right)\)
PTHH: \(MO+H_2SO_4\rightarrow MSO_4+H_2O\)
________x------->x_______________________(mol)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
__0,4--------->0,2_________________________(mol)
=> x + 0,2 = 0,7
=> x = 0,5 (mol)
=> \(M_{MO}=\dfrac{20}{0,5}=40\) (g/mol)
=> MM = 24 (g/mol)
=> Mg
CTHH: MgO
Đúng 0
Bình luận (0)
Cho chất X là một loại tinh thể ngậm nước có công thức RSO4. kH2O (với R là kim loại có hoá trị không đổi). Hoà tan hoàn toàn 23,40 gam X vào nước thu được dung dịch X. Chia dung dịch X thành 2 phần bằng nhau. + Phần 1: Cho tác dụng với dung dịch BaCl2 dư thu được 17,475 gam một chất kết tủa. + Phần 2: Cho tác dụng với dung dịch KOH dư thu được kết tủa Y. Lọc lấy kết tủa Y đem nung ngoài không khí đến khối lượng không đổi thu được 3,00 gam chất rắn.a) Xác định công thức hoá học của chất...
Đọc tiếp
Cho chất X là một loại tinh thể ngậm nước có công thức RSO4. kH2O (với R là kim loại có hoá trị không đổi). Hoà tan hoàn toàn 23,40 gam X vào nước thu được dung dịch X. Chia dung dịch X thành 2 phần bằng nhau.
+ Phần 1: Cho tác dụng với dung dịch BaCl2 dư thu được 17,475 gam một chất kết tủa.
+ Phần 2: Cho tác dụng với dung dịch KOH dư thu được kết tủa Y. Lọc lấy kết tủa Y đem nung ngoài không khí đến khối lượng không đổi thu được 3,00 gam chất rắn.
a) Xác định công thức hoá học của chất X.
b) Tính tổng số nguyên tử của các nguyên tố có trong 31,2 gam X.
Cho 21,6 g một oxit kim loại chưa rõ hóa trị tác dụng với dung dịch H2SO4 dư. sau phản ứng thu được 45,6 g muối. Tìm tên kim loại.
gọi CT của oxit kim loại đó là M2On
M2On+nH2SO4-->M2(SO4)n+nH2O
\(\dfrac{21,6}{2R+16n}\)--------\(\dfrac{45,6}{2R+96n}\) (mol)
Theo PTHH ta có:
\(\dfrac{21,6}{2R+16n}=\dfrac{45,6}{2R+96n}\)
=>48R-1344n=0
nghiệm đúng:n=2;R=56
Vậy kim loại đó là sắt (Fe)
Đúng 0
Bình luận (0)
Cho cùng một lượng các kim loại Al, Zn, Mg lần lượt tác dụng hết với dung dịch H 2 SO 4 loãng, sau phản ứng thu được muối sunfat (tạo bởi kim loại kết hợp với nhóm SO 4 ) và khí H 2 . Vậy thể tích khí H 2 thoát ra từ kim loại nào lớn nhất?
có ai giúp mik ik
Gọi mMg = mZn = mFe = a(g)
\(n_{Mg}=\dfrac{a}{24}\left(mol\right),n_{Al}=\dfrac{a}{27}\left(mol\right)\\ n_{Zn}=\dfrac{a}{65}\left(mol\right),n_{Fe}=\dfrac{a}{56}\left(mol\right)\\ Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
\(\dfrac{a}{24}\) --> \(\dfrac{a}{24}\left(mol\right)\) (1)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(\dfrac{a}{27}\) --> \(\dfrac{a}{16}\left(mol\right)\) (2)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(\dfrac{a}{65}\) --> \(\dfrac{a}{65}\left(mol\right)\) (3)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(\dfrac{a}{56}\) --> \(\dfrac{a}{56}\left(mol\right)\) (4)
Từ (1),(2),(3),(4) có: \(\dfrac{a}{16}>\dfrac{a}{24}>\dfrac{a}{56}>\dfrac{a}{65}\)
Vậy \(V_{H_2}\) thoát ra từ kim loại \(Al\) là lớn nhất
Đúng 0
Bình luận (0)
Cho 2,16 gam một kim loại R hoá trị III tác dụng hết với lượng khí oxi dư, thu được 4,08 gam một oxit có dạng R 2 O 3 . Xác định tên và kí hiệu hoá học của kim loại R.
Cho 3,6 gam kim loại R hoá trị II tác dụng vừa đủ với 150 gam dung dịch HCl thấy thoát ra 3,36 lít khíH2 (ở đktc).a) R là kim loại gì?b) Tính C% của dung dịch axit đã dùng.c) Tính C% của chất tan trong dung dịch sau phản ứng.
a) nH2=0,15(mol)
PTHH: R + 2 HCl -> RCl2 + H2
0,15______0,3____0,15___0,15(mol)
M(R)=mR/nR=3,6/0,15= 24(g/mol)
=> R(II) cần tìm là Magie (Mg=24)
b) PTHH: Mg + 2 HCl -> MgCl2 + H2
mHCl=0,3.36,5=10,95(g)
=>C%ddHCl= (10,95/150).100= 7,3%
c) mH2= 0,15.2=0,3(g)
mddMgCl2= mMg + mddHCl - mH2= 3,6+ 150 - 0,3= 153,3(g)
mMgCl2=0,15.95=14,25(g)
=> \(C\%ddMgCl2=\dfrac{14,25}{153,3}.100\approx9,295\%\)
Đúng 1
Bình luận (0)
Khi cho oxit của một kim loại hoá trị n tác dụng với dung dịch N H O 3 dư thì tạo thành 34,0 g muối nitrat và 3,6 g nước (không có sản phẩm khác). Hỏi đó là oxit của kim loại nào và khối lượng của oxit kim loại đã phản ứng là bao nhiêu ?
Phản ứng chỉ tạo ra muối nitrat và nước, chứng tỏ n là hoá trị duy nhất của kim loại trong oxit. Đặt công thức của oxit kim loại là M 2 O n và nguyên tử khối của M là A.
Phương trình hoá học :
M 2 O n + 2n H N O 3 → 2 M ( N O 3 ) n + n H 2 O (1)
Theo phản ứng (1), khi tạo thành 1 mol [tức (A + 62n gam)] muối nitrat thì đồng thời tạo thành 0,5 mol (tức 9n gam) nước.
(A + 62n) gam muối nitrat - 9n gam nước
34 gam muối nitrat - 3,6 gam nước
Ta có tỉ lệ: 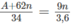
Giải phương trình được A = 23n. Chỉ có nghiệm n = 1, A = 23 là phù hợp. Vậy kim loại M trong oxit là natri.
Phản ứng giữa Na2O và HNO3:
Na2O + 2HNO3 → 2NaNO3 + H2O (2)
Theo phản ứng (2) :
Cứ tạo ra 18 gam H2O thì có 62 gam Na2O đã phản ứng
Vậy tạo ra 3,6 gam H2O thì có x gam Na2O đã phản ứng
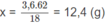
Đúng 0
Bình luận (0)
Hoà tan hoàn toàn một oxit kim loại M (hoá trị không đổi) vào lượng vừa đủ dung dịch H2SO4 10% tạo dung dịch X chứa một muối nồng độ 11,243%.a) Xác định oxit kim loại trên.b) Viết phương trình phản ứng trong các trường hợp sau (kèm điều kiện phản ứng, nếu có).+ Điều chế kim loại tương ứng từ oxit trên.+ Hoà tan oxit trên trong dung dịch NaOH dư.+ Cho dung dịch X tác dụng với dung dịch Na2CO3.
Đọc tiếp
Hoà tan hoàn toàn một oxit kim loại M (hoá trị không đổi) vào lượng vừa đủ dung dịch H2SO4 10% tạo dung dịch X chứa một muối nồng độ 11,243%.
a) Xác định oxit kim loại trên.
b) Viết phương trình phản ứng trong các trường hợp sau (kèm điều kiện phản ứng, nếu có).
+ Điều chế kim loại tương ứng từ oxit trên.
+ Hoà tan oxit trên trong dung dịch NaOH dư.
+ Cho dung dịch X tác dụng với dung dịch Na2CO3.
a) Đặt công thức oxít M2On
Ptpư: M2On + nH2SO4 → M2(SO4)n + nH2O
mol 1 n 1
mddH2SO4 = n.98.100/10 = 980n gam
mdd muối = 2M + 996n (gam)
→ C% muối = (2M + 96n) : (2M + 996n) = 0,11243
→ M = 9n → M = 27 (Al)
→ Công thức oxít: Al2O3
b) ptpứ: Al2O3 ---> 2Al + 3/2O2
Al2O3 + 2NaOH ---> 2NaAlO2 + H2O
Al2(SO4)3 + 3Na2CO3 + 3H2O ---> 2Al(OH)3 + 3Na2SO4 + 3CO2
Đúng 1
Bình luận (0)


















