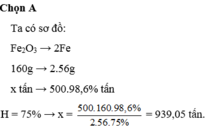Để có 1 tấn thép (98% Fe) cần dùng bao nhiêu tấn quặng hematit nâu ( Fe 2 O 3 . 2 H 2 O ) ? Hàm lượng hematit nâu trong quặng là 80%. Hiệu suất quá trình phản ứng là 93%.

Những câu hỏi liên quan
Nhà máy sản xuất thép miền Nam đã sử dụng quặng hematit chứa 60% Fe2O3 để sản xuất 2 tấn gang chứa 90% Fe. Hiệu suất của cả quá trình là 80%. Khối lượng quặng hematit nhà máy cần dùng là ?
Rất mong được mọi người giúp đỡ ạ !!!
Ta có: mFe = 2.90% = 1,8 (tấn) = 1800000 (g)
\(\Rightarrow n_{Fe}=\dfrac{1800000}{56}=\dfrac{225000}{7}\left(mol\right)\)
BTNT Fe, có: nFe2O3 = 1/2nFe = 112500/7 (mol)
\(\Rightarrow m_{Fe_2O_3}=\dfrac{112500}{7}.160=\dfrac{18000000}{7}\left(g\right)=\dfrac{18}{7}\left(tan\right)\)
Vì: H% = 80% ⇒ mFe2O3 (thực tế) = 18/7:80% = 45/14 (tấn)
Mà: Quặng hematit chứa 60% Fe2O3
⇒ mquặng = 45/14:60% ≃ 5,36 (tấn)
Đúng 1
Bình luận (0)
Đúng 0
Bình luận (0)
Để luyện được 500 tấn thép cacbon (thành phần gồm Fe và C) chứa 1,4% C, cần dùng x tấn quặng hematit đỏ chứa 0% tạp chất trơ. Hiệu suất quá trình là 75%. Giá trị của x là
A. 939,05.
B. 528,21.
C. 1878,10.
D. 1056,43
Ta có sơ đồ:
Fe 2 O 3 → 2 Fe
160g → 2.56g
x tấn → 500.98,6% tấn
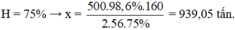
Chọn đáp án A.
Đúng 0
Bình luận (0)
Để luyện được 500 tấn thép cacbon (thành phần gồm Fe và C) chứa 1,4% C, cần dùng x tấn quặng hematit đỏ chứa 0% tạp chất trơ. Hiệu suất quá trình là 75%. Giá trị của x là
A. 939,05.
B. 528,21.
C. 1878,10.
D. 1056,43.
Để luyện được 500 tấn thép cacbon (thành phần gồm Fe và C) chứa 1,4% C, cần dùng x tấn quặng hematit đỏ chứa 0% tạp chất trơ. Hiệu suất quá trình là 75%. Giá trị của x là
A. 939,05.
B. 528,21.
C. 1878,10.
D. 1056,43.
Chọn A
Ta có sơ đồ:
F e 2 O 3 → 2 F e
160g → 2.56g
x tấn → 500.98,6% tấn
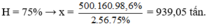
Đúng 0
Bình luận (0)
Để có 1 tấn thép (98% Fe) cần dùng bao nhiêu tấn quặng hematit nâu (Fe203.2H20) ? Hàm lượng hematit nâu trong quặng là 80%. Hiệu suất quá trình phản ứng là 93%.
Giup mình vs nhé:))
Khối lượng Fe: 1×98100=0,981×98100=0,98 (tấn)
Trong 196 tấn (Fe2O3.2H2O)(Fe2O3.2H2O) có 112 tấn Fe
x tấn ←← 0,98 tấn Fe
x = 1,715 (tấn)
Khối lượng quặng : 1,715×100/80=2,144 (tấn )
Khối lượng quặng thực tế cần dùng: 2,144×100/93=2,305 (tấn )
Đúng 0
Bình luận (0)
Khối lượng Fe: 1×98100=0,98 (tấn)
Trong 196 tấn (Fe2O3.2H2O) có 112 tấn Fe
x tấn ← 0,98 tấn Fe
x = 1,715 (tấn)
Khối lượng quặng : 1,715×10080=2,144 (tấn )
Khối lượng quặng thực tế cần dùng: 2,144×10093=2,305 (tấn )
1. Tính khối lượng sắt có trong:
a. 100 tấn quăng hematit chứa 60% Fe2O3
b. 100 tấn quặng manhetit chứa 69,6% Fe3O4
2. Cần trộn 2 loại quặng trên theo tỉ lệ nào để từ 1 tấn quặng đã trộn người ta điều chế được 0,5 tấn gang( chứa 96% sắt và 4% cacbon)?
Dùng 12 tấn quặng hematit có chứa 85% Fe2O3 để luyện gang (chứa 96% Fe). Hiệu suất quá trình phản ứng là 80%. Khối lượng gang thu được là bao nhiêu.
Giúp e vs ạ, em cần gấp
\(m_{Fe_2O_3}=12000.85\%=10200(kg)\\ \Rightarrow n_{Fe_2O_3}=\dfrac{10200}{160}=63,75(kmol)\\ \Rightarrow n_{Fe_2O_3(p/ứ)}=63,75.80\%=51(kmol)\\ \Rightarrow n_{Fe}=2n_{Fe_2O_3}=102(kmol)\\ \Rightarrow m_{Fe}=102.56=5712(kg)\\ \Rightarrow m_{gang}=\dfrac{5712}{96\%}=5950(kg)=5,95(tấn)\)
Đúng 2
Bình luận (0)
X là quặng hematit đỏ chứa 64% Fe2O3 (còn lại là tạp chất không chứa nguyên tố Fe) . Y là quặng manhetit chứa 92,8% Fe3O4 ( còn lại là tạp chất không chứa nguyên tố Fe) . Trộn m1 tấn quặng X với m2 tấn quặng Y thu được 1 tấn hỗn hợp Z. Đem toàn bộ Z luyện gang, rồi luyện thép thì thu được 420,42 kg thép chứa 0,1% gồm cacbon và các tạp chất. Giả thiết hiệu suất toàn bộ quá trình là 75%. Tỉ lệ m1 : m2 là A. 2:1 B. 3:4 C. 1:1 D. 1:2
Đọc tiếp
X là quặng hematit đỏ chứa 64% Fe2O3 (còn lại là tạp chất không chứa nguyên tố Fe) . Y là quặng manhetit chứa 92,8% Fe3O4 ( còn lại là tạp chất không chứa nguyên tố Fe) . Trộn m1 tấn quặng X với m2 tấn quặng Y thu được 1 tấn hỗn hợp Z. Đem toàn bộ Z luyện gang, rồi luyện thép thì thu được 420,42 kg thép chứa 0,1% gồm cacbon và các tạp chất. Giả thiết hiệu suất toàn bộ quá trình là 75%. Tỉ lệ m1 : m2 là
A. 2:1
B. 3:4
C. 1:1
D. 1:2
Hematit nâu là một loại quặng sắt quan trọng dùng để luyện gang, thép. Thành phần chính của quặng hematit nâu là A. FeCO3. B. Fe3O4. C. Fe2O3.nH2O. D. Fe2O3
Đọc tiếp
Hematit nâu là một loại quặng sắt quan trọng dùng để luyện gang, thép. Thành phần chính của quặng hematit nâu là
A. FeCO3.
B. Fe3O4.
C. Fe2O3.nH2O.
D. Fe2O3