Dẫn V lít (đktc) khí SO2 vào 200 ml dung dịch KOH 1M thu được 12 gam muối KHSO3. Vậy V có giá trị là:
A. 2,24 lit
B. 3,36 lít
C. 4,48 lit
D. 5,6 lit
Dẫn V lít (đktc) khí SO2 vào 200 ml dung dịch KOH 1M thu được 12 gam muối KHSO3. Vậy V có giá trị là bao nhiêu?
Cho 5,6 lit khí SO2 (ở đktc) vào 300 ml dung dịch KOH 1M sau phản ứng thu được m (g) muối. Tìm m= ?
\(n_{SO_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
nKOH = 0,3.1 = 0,3 (mol)
PTHH: 2KOH + SO2 --> K2SO3 + H2O
0,3-->0,15--->0,15
K2SO3 + SO2 + H2O --> 2KHSO3
0,1<--0,1----------------->0,2
=> hh muối gồm \(\left\{{}\begin{matrix}K_2SO_3:0,05\left(mol\right)\\KHSO_3:0,2\left(mol\right)\end{matrix}\right.\)
=> m = 0,05.158 + 0,2.120 = 31,9 (g)
Tính khối lượng các chất thu được sau phản ứng trong các trường hợp sau:
a) Cho 17,92 lít hiđrosunfua (đktc) vào 1,26 lit dung dịchNaOH 1M.
b) Dẫn 6,72 lít khí hiđrosunfua (đktc) vào 150ml dung dịch KOH 2M.
c) Dẫn 2,24 lit khí hiđrosunfua (đktc) vào 300 ml dung dịch NaOH 1M
d) Hấp thụ hoàn toàn 12,8g SO2vào 250 ml dung dịchNaOH 1M.
e) Dẫn 13,44 lit SO2(đktc) vào 200 ml dung dịch NaOH 2M
f) Cho 5,6 lit khí SO2 (đkc) vào400 ml dung dịch KOH 1,5 M.
a.
nH2S=17.92/22.4=0.8(mol)
nNaOH=1.26*1=1.26(mol)
H2S+2NaOH→2H2O+Na2S
nH2O=nNaOH=1.26(mol)=>mH2O=1.26*18=22.68(gam)
nNa2S=nH2S=0.8(mol)=>mNa2S=0.8*78=62.4(gam)
b.
nH2S=6.72/22.4=0.3(mol)
nKOH=0.15*2=0.3(mol)
H2S+2KOH→2H2O+K2S
nH2O=nKOH=0.3(mol)=>mH2O=0.3*18=5.4(gam)
nK2S=nH2S=0.3(mol)=>mK2S=0.3*78=23.4(gam)
c.
nH2S=2.24/22.4=0.1(mol)
nNaOH=0.3*1=0.3(mol)
H2S+2NaOH→2H2O+Na2S
nH2O=nNaOH=0.1(mol)=>mH2O=0.1*18=1.8(gam)
nNa2S=nH2S=0.3(mol)=>mNa2S=0.3*78=23.4(gam)
d.
nSO2=12.8/64=0.2(mol)
nNaOH=0.25*1=0.25(mol)
2NaOH+SO2→H2O+Na2SO3
nH2O=nSO2=0.2(mol)=>mH2O=0.2*18=3.6(gam)
nNa2SO3=nSO2=0.2(mol)=>mNa2SO3=0.2*126=25.2(gam)
e.
nSO2=13.44/64=0.21(mol)
nNaOH=0.2*2=0.4(mol)
2NaOH+SO2→H2O+Na2SO3
nH2O=nSO2=0.21(mol)=>mH2O=0.21*18=3.78(gam)
nNa2SO3=nSO2=0.4(mol)=>mNa2SO3=0.4*126=50.4(gam)
f.
nH2S=5.6/22.4=0.25(mol)
nKOH=0.4*1.5=0.6(mol)
H2S+2KOH→2H2O+K2S
nH2O=nKOH=0.25(mol)=>mH2O=0.25*18=4.5(gam)
nK2S=nH2S=0.6(mol)=>mK2S=0.6*78=46.8(gam)
Hấp thụ hoàn toàn 2,24 lit khí CO2 ( đktc) vào 200 ml dung dịch KOH 2 M thu được dung dịch X. Cho từ từ dung dịch HCl 2,5 M vào X đến khi bắt đầu có khí sinh ra thì hết V ml. Giá trị của V là
A. 120
B. 80
C. 40
D. 60
Hấp thụ hoàn toàn 2,24 lit khí C O 2 ( đktc) vào 200 ml dung dịch KOH 2 M thu được dung dịch X. Cho từ từ dung dịch HCl 2,5 M vào X đến khi bắt đầu có khí sinh ra thì hết V ml. Giá trị của V là
A. 80
B. 60
C. 120
D. 40
Hấp thụ hoàn toàn 2,24 lit khí CO2 ( đktc) vào 200 ml dung dịch KOH 2 M thu được dung dịch X. Cho từ từ dung dịch HCl 2,5 M vào X đến khi bắt đầu có khí sinh ra thì hết V ml. Giá trị của V là
A. 120
B. 80
C. 40
D. 60
Sục V lít khí CO2 (đktc) vào 200 ml dung dịch gồm NaOH 0,75M và KOH 1M thu được dung dịch X chứa 4 muối. Cho từ từ đến hết dung dịch X vào 100 ml dung dịch chứa HCl 0,9M và H2SO4 0,95M thu được 4,48 lít CO2 (đktc) và dung dịch Y. Cho BaCl2 dư vào dung dịch Y thu được lượng kết tủa lớn hơn 24,0 gam. Giá trị của V là
A. 6,72 lít
B. 7,84 lít
C. 5,60 lít
D. 8,96 lít
Định hướng tư duy giải
Trong dung dịch X
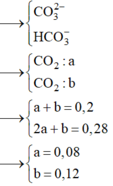
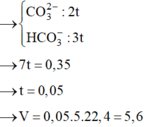
Câu 23. Cho 100,0ml dung dịch X chứa HCl 1M và H2SO4 1M vào 200ml dung dịch Ba(HCO3)2 0,75M thu được V lít khí CO2 (đktc) và m gam kết tủa. Vậy giá trị của V và m tương ứng là:
A. 6,72 và 23,3 B. 4,48 và 34,95 C. 3,36 và 46,6 D. 2,24 và 23,3
\(n_{HCl}=0,1\left(mol\right)\\ n_{H_2SO_4}=0,1\left(mol\right)\\ n_{Ba\left(HCO_3\right)_2}=0,15\left(mol\right)\\ Ba\left(HCO_3\right)_2+H_2SO_4\rightarrow BaSO_4\downarrow+2CO_2+2H_2O\\ Ba\left(HCO_3\right)_2\left(còn\right)+2HCl\rightarrow BaCl_2+2CO_2+2H_2O\\ n_{CO_2}=0,1.2+0,05.2=0,3\left(mol\right)\\ V_{CO_2\left(đktc\right)}=0,3.22,4=6,72\left(l\right)\\ n_{BaSO_4}=0,1\left(mol\right)\\ m_{\downarrow}=m_{BaSO_4}=233.0,1=23,3\left(g\right)\\ ChọnA\)
Đốt cháy lưu huỳnh trong bình chứa 6,72 lit O2 (đktc) thu đươc một thể tích khí SO2 :
A. 2,24 lít B. 4,48 lít C. 1,12 lít D. 3,36 lít
\(n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PT: \(S+O_2\underrightarrow{t^o}SO_2\)
Theo PT: \(n_{SO_2}=n_{O_2}=0,3\left(mol\right)\Rightarrow V_{SO_2}=0,3.22,4=6,72\left(l\right)\)