100ml dung dịch X chứa N a 2 S O 4 0,1M và N a 2 C O 3 0,1M tác dụng hết với dung dịch B a N O 3 2 dư. Khối lượng kết tủa thu được là
A. 4,3 gam.
B. 2,93 gam.
C. 3,4 gam.
D. 2,39 gam.
Dung dịch X thu được khi trộn một thể tích dung dịch H2SO4 0,1M với một thể tích dung dịch HCl 0,2M . Dung dịch Y chứa NaOH 0,2M và Ba(OH)2 0,1M . Đổ 100ml dung dịch X vào 100ml dung dịch Y , khuấy đều để phản ứng xảy ra hoàn toàn , thu được 200ml dung dịch X có pH=a và m gam kết tủa Y . Giá trị của a và m là ?
Ta có: \(\Sigma n_{H^+}=0,1.0,1.2+0,1.0,2=0,04\left(mol\right)\)
\(\Sigma n_{OH^-}=0,1.0,2+0,1.0,1.2=0,04\left(mol\right)\)
PT ion: \(H^++OH^-\rightarrow H_2O\)
_____0,04____0,04_________ (mol)
⇒ H+ pư vừa đủ với OH-
⇒ a = pH = 7
Ta có: \(n_{SO_4^{2-}}=0,1.0,1=0,01\left(mol\right)\)
\(n_{Ba^{2+}}=0,1.0,1=0,01\left(mol\right)\)
PT ion: \(SO_4^{2-}+Ba^{2+}\rightarrow BaSO_{4\downarrow}\)
_______0,01___0,01______0,01___ (mol)
\(\Rightarrow m=m_{BaSO_4}=0,01.233=2,33\left(g\right)\)
Bạn tham khảo nhé!
cho ai chưa biết thì nH+ tùy theo lượng H trong acid. Ví dụ như ở bài này là nH+(H2SO4)= 2nH2SO4 và NH+(HCl)= nHCl
Vậy nên bài bạn Lê Ng Hải Anh làm rất đúng, không sai chỗ nào để tôi có thể sửa =))
Cho 100ml dung dịch HNO3 0,1M vào 100ml dung dịch NaOH thì thu được dung dịch có chứa 0,806 gam chất tan . Vậy pH của dung dịch sau phản ứng trên là ?
Bài 1: Trên 2 đĩa cân ở vị trí cân bằng, có 2 cốc thủy tinh với khối lượng bằng nhau và đều chứa 1 dung dịch HCl như nhau. Nếu thêm vào cốc thứ nhất m1 gam Fe và cốc thứ hai m2 gam CaCO3, khi pứ hòa tan hết thì đĩa cân trở lại vị trí cân bằng. Tìm tỉ lệ \(\dfrac{m_1}{m_2}\)
Bài 2:
A là dung dịch H2SO4, B là dung dịch NaOH
a. Đổ 100ml dung dịch A vào 100ml dung dịch B thì được dung dịch C. Cho quỳ tím vào C thấy có màu đỏ. Thêm từ từ 40ml dung dịch NaOH 0,1M vào dung dịch C thấy quỳ trở lại màu tím
b. Đổ 300ml dung dịch B vào 100ml dung dịch A thì thu được dung dịch D. Cho quỳ tím vào D thấy có màu xanh. Thêm từ từ 40ml dung dịch HCl 0,1M vào dung dịch D thấy quỳ trở lại màu tím.
Tính nồng độ mol các dung dịch A và B
a) trộn 100ml HCl 0,1M với 200ml nạp 0,2M thu được 300 ml dung dịch X. Tính pH của dung dịch X.
b) trộn 100ml dung dịch X chứa H2SO4 và HNO3 có pH=1 với 100ml dung dịch Ba(OH)2 xM thu được dung dịch có pH=12. Tính X
Một dung dịch X có chứa 0,01 mol B a 2 + Ba2+ ; 0,01 mol N O 3 − NO3− ; a mol O H − OH− và b mol N a + Na+ . Để trung hoà một nửa dung dịch X người ta cần dùng 200 ml dung dịch HCl 0,1M. Khối lượng chất rắn thu được khi cô cạn dung dịch X là:
Để trung hòa nửa dung dịch X cần 200ml dd HCl 0,1M
→ Để trung hòa dung dịch X cần 200 . 2 = 400ml dd HCl 0,1M
nHCl cần để trung hòa\(\text{ X = 0,4 . 0,1 = 0,04 mol}\)
nH+ = nHCl = 0,04 mol
H+ + OH- → H2O
0,04→0,04
ADĐLBT điện tích: 2 . nBa2+ + nNa+ = nNO3- + nOH-
→ nNa+ = 0\(\text{,01 + 0,04 - 0,01 . 2 = 0,03 mol}\)
Cô cạn X:
mcr = mBa2+ + mNO3- + mOH- + mNa+
\(\text{= 0,01 . 137 + 0,01 . 62 + 0,04 . 17 + 0,03 . 23}\)
\(\text{ = 3,36 (g)}\)
Trộn 100ml dung dịch chứa H2SO4 0,1M và HNO3 0,3M với 100ml dung dịch chứa Ba(OH)2 0,3M và KOH 0,1M thu được dung dịch X và kết tủa Y. Cho quỳ tím vào dung dịch Y, hiện tượng gì xảy ra ?
A. tím chuyển sang đỏ
B. quỳ tím chuyển sang xanh
C. quỳ tím không chuyển màu
D. quỳ tím mất màu
Đáp án B
nH+ = 0,05 mol; nOH- = 0,07 mol
H+ + OH- → H2O
Ta thấy H+ hết, OH- dư nên nhúng quỳ tím vào Y thì quỳ tím chuyển thành màu xanh.
Bài tập về kim loại kiềm và nhôm tác dụng với H2O
Đem hòa tan x gam Na vào 200ml dung dịch Ba(OH)2 0,1M thu được dung dịch A. Cho từ từ dung dịch A vào 100ml dung dịch Al2(SO4)3 0,1M thu được y gam kết tủa. Tìm trih số của x để y có trị số lớn nhất.
Na + H2O → NaOH + 1/2 H2
x/23..........................x/23........x/46 (mol)
nBa(OH)2 = 0,02 (mol)
Dung dịch A có x/23 (mol) NaOH và 0,02 (mol) Ba(OH)2
nAl2(SO4)3 = \(\frac{100\cdot0,1}{1000}\) = 0,01 (mol)
y max => baso pư vừa đủ
6NaOH + Al2(SO4)3 → 2Al(OH)3↓ + 3Na2SO4
(mol) x/23..............x/ 138.................x/69........................3x/23
3 Ba(OH)2 + Al2(SO4)3 → 3BaSO4↓ + 2Al(OH)3↓
(mol) 0,02....................0,02/3
Theo đề ta có : \(\frac{x}{138}\) + \(\frac{0,02}{3}\) = 0,01
<=> x = 0,52 (gam)
Vậy để y có trị số lớn nhất thì x = 0,52 gam
Đặt :
nNa= a mol
Na + H2O --> NaOH + 1/2H2
a_____________a
dd A: a mol NaOH , 0.02 mol Ba(OH)2
nAl2(SO4)3 = 0.1*0.1 = 0.01 mol
Cho A vào dd Al2(SO4)3 :
6NaOH + Al2(SO4)3 --> 3Na2SO4 + 2Al(OH)3
a__________a/6
3Ba(OH)2 + Al2(SO4)3 --> 3BaSO4 + 2Al(OH)3
0.02_________1/150
Để lượng kết tủa lớn nhất thì : OH- và Al2(SO4)3 đủ
<=> nAl2(SO4)3 = 0.01
<=> a/6 + 1/150 = 0.01
<=> a = 0.02
mNa = 0.02 * 23 = 0.46 g
Cho 100ml dung dịch Ba(O H ) 2 0,1M vào 100ml dung dịch HCl 0,1M. Dung dịch thu được sau phản ứng
A. Làm quỳ tím hoá xanh
B. Làm quỳ tím hoá đỏ
C. Phản ứng được với magie giải phóng khí hiđro
D. Không làm đổi màu quỳ tím
Chọn A
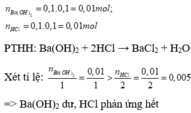
=> Dung dịch sau phản ứng thu được gồm BaC l 2 và Ba(O H ) 2 dư
Vì BaC l 2 là muối, không làm đổi màu quỳ, còn Ba(O H ) 2 là bazơ làm quỳ hóa xanh
=> dung dịch thu được sau phản ứng làm quỳ hóa xanh
1) cho m gam Ba(OH)2 vào nước thu được 200ml dung dịch X có pH=13. Tìm m.
2) cho 100ml dung dịch KOH 0,1M vào 100ml dung dịch H2SO4 CÓ pH=1. Xác định môi trường của dung dịch sau phản ứng.
3)cho 40,l dung dịch HCl 0,75M tác dụng 160ml dung dịch hỗn hợp Ba(OH)2 0,08M và KOH 1,04M thu duco975 dung dịch X. Tính pH của X.
4) Trộn 300ml dung dịch HCl 0,05M với 200ml dung dịch Ba(OH)2 a(M) thu được dung dịch X có pH=12. Tìm a.
Trộn 100ml dung dịch B gồm Ba(OH)2 0,05M; NaOH 0,3M với 100ml dung dịch A chứa FeCl2 0,2M và H2SO4 0,1M thì thu được bao nhiêu gam kết tủa?
\(n_{Ba^{2+}}=0.1\cdot0.05=0.005\left(mol\right)\)
\(n_{OH^-}=0.1\cdot0.05\cdot2+0.1\cdot0.3=0.04\left(mol\right)\)
\(n_{Fe^{2+}}=0.1\cdot0.2=0.02\left(mol\right)\)
\(n_{SO_4^{2-}}=0.1\cdot0.1=0.01\left(mol\right)\)
\(n_{H^+}=0.1\cdot0.1\cdot2=0.02\left(mol\right)\)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\)
\(0.005....0.005..........0.005\)
\(\Rightarrow SO_4^{2-}dư\)
\(OH^-+H^+\rightarrow H_2O\)
\(0.02.......0.02\)
\(Fe^{2+}+2OH^-\rightarrow Fe\left(OH\right)_2\)
\(0.01....0.04-0.02....0.01\)
\(\Rightarrow Fe^{2+}dư\)
\(m\downarrow=0.005\cdot197+0.01\cdot90=2.065\left(g\right)\)