a. Tìm khối lượng mol của lưu huỳnh ( MS ) ; khối lượng mol của khí sunfuro (MSO2).
b. Viết PTHH cho phản ứng cháy của lưu huỳnh.
Tìm Hợp Chất oxít của lưu huỳnh
khối lượng mol của hợp chất là 80g, % khối lượng của lưu huỳnh
40%
tìm công thức
\(m_S=40\%.80=32\left(g\right)\Rightarrow n_S=\dfrac{32}{32}=1\left(mol\right)\)
\(m_O=80-32=48\left(g\right)\Rightarrow n_O=\dfrac{48}{16}=3\left(mol\right)\)
Vậy CTHH của hợp chất là SO3
Câu 34. Lưu huỳnh cháy trong khí oxi, ta có phương trình khối lượng:
mS + mO2 = mSO2
Cho biết tổng khối lượng của lưu huỳnh và oxi là 46 gam. Hãy xác định khối lượng của khí sunfuarơ (SO2) thu được là bao nhiêu gam?
A. 64 gam B. 32 gam
C. 46 gam D. Chưa thể xác định
Theo ĐLBTKL:
mSO2 = mS + mO2 = 46(g)
=> C
Tìm CTHH của một oxit lưu huỳnh, trong đó nguyên tố oxi chiếm 60% về khối lượng và khối lượng mol của oxit là 80 gam/mol
\(S_xO_y\)
\(x:y=\dfrac{40}{32}:\dfrac{60}{16}=1,25:3,75=1:3\)
\(CTĐG:SO_3\)
\(CTCtrởthành:\left(SO_3\right)n=80\)
\(\Leftrightarrow n=1\)
Vậy CTHH: SO3
CT tổng quát: SxOy
theo đề bài, ta có:
\(\dfrac{x}{y}=\dfrac{100-60}{32}:\dfrac{60}{16}\)=\(\dfrac{1}{3}\)
=> CTHH: SO3
Một chất A có 4% là đồng, 20% là lưu huỳnh còn lại là oxygen.Xác định công thức của A, biết khối lượng mol của A là og/mol Khối lượng cMột chất A có 4% là đồng, 20% là lưu huỳnh còn lại là oxygen.Xác định công thức hóa học của A, biết khối lượng mel của A là 16glmel Khối lượng A là?
Một oxit của lưu huỳnh có thành phần trăm của lưu huỳnh là 50% và Oxi là 50%.Biết oxit này có khối lượng mol phân tử là 64g/mol.Hãy tìm công thức hóa học của oxit đó.
Ta có: \(\left\{{}\begin{matrix}m_S=64\cdot50\%=32\left(g\right)\\m_O=64\cdot50\%=32\left(g\right)\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}n_S=\dfrac{32}{32}=1\left(mol\right)\\n_O=\dfrac{32}{16}=2\left(mol\right)\end{matrix}\right.\)
Vậy CTHH là \(SO_2\)
Câu 4 (1 điểm): Một oxit của lưu huỳnh có thành phần trăm của lưu huỳnh là 50% và Oxi là 50%. Biết oxit này có khối lượng mol phân tử là 64 g/mol. Hãy tìm công thức hóa học của oxit đó.
Cho nguyên tử khối: O=16, Cu=64, Mg=24, Fe=56, Cl=35,5, Ag =108, N=14
\(m_S=\dfrac{64.50}{100}=32\left(g\right)=>n_S=\dfrac{32}{32}=1\left(mol\right)\)
\(m_O=\dfrac{64.50}{100}=32\left(g\right)=>n_O=\dfrac{32}{16}=2\left(mol\right)\)
=> CTHH: SO2
Một oxit lưu huỳnh trong đó có thành phần gồm 2 phần khối lượng nguyên tố S và 3 phần khối lượng nguyên tố O m S / m O = 2 / 3 . Xác định công thức lưu huỳnh đó.
Xác định công thức hóa học một oxi của lưu huỳnh có khối lượng mol là 64g và biết thành phần phần trăm về khối lượng của nguyên tố lưu huỳnh trong oxit là 50%.
Công thức hóa học: S x O y
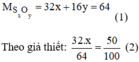
Giải phương trình (2) ta được: x = 1 thay vào pt (1) ⇒ y = 2.
Vậy công thức hóa học của oxit là S O 2
29.7 xác định CTHH một oxit của lưu huỳnh có khối lượng mol là 64 g/mol và biết thành phần phần trăm về khối lượng của nguyên tố lưu huỳnh trong oxit là 50%
Gọi CTHH là SxOy
=> mS = \(\frac{64.50}{100}=32\left(gam\right)\)
\(\Rightarrow n_S=\frac{32}{32}=1\left(mol\right)\)
=> mO = 64 - 32 = 32 (gam)
=> nO = \(\frac{32}{16}=2\left(mol\right)\)
=> x : y = 1 : 2
=> CTHH: SO2
Gọi công thức dạng tổng quát cuả oxit đólà SxOy (x,y: nguyên, dương)
=>\(m_S=\frac{64.50}{100}=32\left(g\right)\)
\(n_S=\frac{m_S}{M_S}=\frac{32}{32}=1\left(mol\right)\)
=>\(m_O=m_{hợpchất}-m_S=64-32=32\left(g\right)\)
\(n_O=\frac{m_O}{M_O}=\frac{32}{16}=2\left(mol\right)\)
=>x:y=1:2
CTHH của oxit: SO2 (lưu huỳnh đioxit)