Trình bày kết quả của thí nghiệm điều chế khí oxi, thu khí oxi và đốt cháy lưu huỳnh trong khí oxi.

Những câu hỏi liên quan
Đốt chày hoàn toàn 9,6g lưu huỳnh trong lọ chưa khí Oxi
a) Tính khối lượng KClO₃ cần dùng để điểu chế khí Oxi cần dùng cho thí nghiệm trên
b) Nếu đốt cháy lượng lưu huỳnh trong bình chứa không khí thì phải cần bao nhiêu lít không khí ở đktc
\(a,PTHH:S+O_2\underrightarrow{t^o}SO_2\left(1\right)\)
\(n_S=\dfrac{m}{M}=\dfrac{9,6}{32}=0,3\left(mol\right)\)
\(Theo.PTHH\left(1\right):n_O=n_S=0,3\left(mol\right)\)
\(PTHH:2KClO_3\underrightarrow{t^o}2KCl+3O_2\\ Theo.PTHH\left(2\right):n_{KClO_3}=\dfrac{2}{3}.n_{O_2}=\dfrac{2}{3}.0,3=0,2\left(mol\right)\\ m_{KClO_3}=n.M=0,2.122,5=24,5\left(g\right)\)
\(b,V_{O_2\left(đktc\right)}=n.22,4=0,2.22,4=4,48\left(l\right)\\ \Rightarrow V_{kk\left(đktc\right)}=5.V_{O_2}=5.4,48=22,4\left(l\right)\)
Đúng 1
Bình luận (0)
Câu 1. Chọn hiện tượng đúng ở thí nghiệm đốt bột lưu huỳnh (sulfur)A. Trong không khí, lưu huỳnh cháy nhanh hơn trong oxiB. Trong oxi, lưu huỳnh cháy nhanh hơn trong không khíC. Lưu huỳnh cháy trong không khí và trong oxi là như nhauD. Lưu huỳnh không cháy trong oxi cũng như trong không khíCâu 2. Hoá lỏng không khí sau đó nâng dần nhiệt độ lên thì thu được khí N2 trước, vì:A. khí N2 ít tan trong nước hơn khí O2B. khí O2 ít tan trong nước hơn khí N2C. khí O2 có nhiệt độ sôi thấp hơn khí N2D. khí...
Đọc tiếp
Câu 1. Chọn hiện tượng đúng ở thí nghiệm đốt bột lưu huỳnh (sulfur)
A. Trong không khí, lưu huỳnh cháy nhanh hơn trong oxi
B. Trong oxi, lưu huỳnh cháy nhanh hơn trong không khí
C. Lưu huỳnh cháy trong không khí và trong oxi là như nhau
D. Lưu huỳnh không cháy trong oxi cũng như trong không khí
Câu 2. Hoá lỏng không khí sau đó nâng dần nhiệt độ lên thì thu được khí N2 trước, vì:
A. khí N2 ít tan trong nước hơn khí O2
B. khí O2 ít tan trong nước hơn khí N2
C. khí O2 có nhiệt độ sôi thấp hơn khí N2
D. khí N2 có nhiệt độ sôi thấp hơn khí O2
Câu 3. Khi nhiệt phân 12,25g kali clorat KClO3, thể tích khí oxi (oxygen) (ở đktc) sinh ra là:
A. 3,36 lít
B. 3,4 lít
C. 3,5 lít
D. 2,8 lít Chọn đáp án đúng (biết O = 16, K = 39, Cl = 35,5).
Câu 4. Cho 2,24 lít khí H2 (hydrogen) ở đktc phản ứng với 8 gam một oxit của kim loại R (có hóa trị II) thì thấy phản ứng xảy ra vừa đủ. Kim loại R là:
A. sắt
B. đồng
C. nhôm
D. kẽm
Câu 5. Người ta dùng H2 hoặc CO để khử sắt (III) oxit (iron(III) oxide) thành sắt (iron). Để điều chế được 3,5 gam sắt, thể tích H2 hoặc CO (ở đktc) cần dùng là:
A. 4,2 lít H2 hoặc 2,1 lít CO
B. 1,05 lít H2 hoặc 2,1 lít CO
C. 4,2 lít H2 hoặc 4,2lít CO
D. 2,1 lít H2 hoặc 2,1 lít CO
Câu 6. Chọn phương trình hoá học đúng của phản ứng giữa H2 và O2
A. ¬ H2 + O2 -> H2O
B. 2H2 + O2 -> H2O
C. 2H2 + O2 -> 2H2O
D. 2H2O -> 2H2 + O2
Câu 7. Chọn hiện tượng đúng nhất khi cho H2 tác dụng với CuO ở nhiệt độ 400oC:
A. Bột màu đen chuyển dần sang màu đỏ và có hơi nước tạo thành đầu ra ống dẫn khí.
B. Có những giọt nước tạo thành tạo thành đầu ra ống dẫn khí.
C. Bột màu đen chuyển dần sang màu đỏ.
D. Có lớp CuO màu đỏ gạch.
Câu 8. Cho 3,36 lít khí hidro (hydrogen) (đktc) tác dụng với khí oxi (oxygen) dư thu được m gam nước. Tính giá trị của m là
A. 2,7.
B. 4,5.
C. 1,8.
D. 3,6.
Câu 9. Khí H2 được dùng làm nhiên liệu vì lí do nào trong các lí do sau đây?
A. phản ứng của H2 với O2 toả nhiều nhiệt
B. phản ứng giữa H2 và oxit kim loại toả nhiều nhiệt
C. H2 kết hợp được với O2 tạo ra nước
D. H2 là chất khí nhẹ nhất
Câu 10. Người ta điều chế 3,2 gam đồng (copper) bằng cách dùng hiđro (hydrogen) khử đồng (II) oxit. (copper(II) oxide) a) Khối lượng đồng (II) oxit bị khử là:
A. 1,5 gam
C. 6,0 gam
B. 4,5 gam
D. 4,0 gam
b) Thể tích khí hiđro (đktc) đã dùng là:
A. 1,12 lít
C. 0,42 lít
B. 1,26 lít
D. 1,68 lít
mấy câu còn lại tách ra chứ nhìn vô kiủ.......
Đúng 1
Bình luận (0)
trong phòng thí nghiệm để điều chế sắt từ oxit ngta đốt cháy sắt trong khí oxintinh1 khối lượng sắt và khí oxi cần dùng để điều chế đc 4.64g sat71 từ oxi
\(n_{Fe_3O_4}=\dfrac{m_{Fe_3O_4}}{M_{Fe_3O_4}}=\dfrac{4,64}{232}=0,02mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,06 0,04 0,02 ( mol )
\(m_{Fe}=n_{Fe}.M_{Fe}=0,06.56=3,36g\)
\(m_{O_2}=n_{O_2}.M_{O_2}=0,04.32=1,28g\)
Đúng 3
Bình luận (0)
\(pthh:3Fe+2O_2\overset{t^o}{--->}Fe_3O_4\)
Ta có: \(n_{Fe_3O_4}=\dfrac{4,64}{232}=0,02\left(mol\right)\)
Theo pt: \(n_{Fe}=3.0,02=0,06\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,06.56=3,36\left(g\right)\)
Theo pt: \(n_{O_2}=2.0,02=0,04\left(mol\right)\)
\(\Rightarrow m_{O_2}=0,04.32=1,28\left(g\right)\)
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn 3.2 gam lưu huỳnh trong khí oxi, thu được lưu huỳnh đioxit
A. Viết phương trình HH của phản ứng xảy ra?
B. Tính thể tích khí oxi ở đktc cần dùng?
Xem chi tiết
a) PTHH : \(S+O_2->SO_2\)
b) Ta có : \(n_S\) = \(\dfrac{m_S}{M_S}\) = 0.1 (mol)
Có : \(n_S=n_{O_2}\)
--> \(n_{O_2}\) = 0.1 (mol)
=> \(V_{O_2\left(đktc\right)}\) = \(n_{O_2}\) . 22.4 = 2.24 (L)
Đúng 2
Bình luận (0)
\(n_S=\dfrac{3,2}{32}=0,1\left(mol\right)\\ PTHH:S+O_2\underrightarrow{t^o}SO_2\\ \left(mol\right)..0,1\rightarrow0,1..0,1\\ V_{O_2}=0,1.22,4=2,24\left(l\right)\)
Đúng 0
Bình luận (0)
Bài tập 2:Đốt cháy sắt trong khí oxi, sau phản ứng thu được 11,6g oxit sắt từ Fe3O4a. Viết PTHHb. Tính thể tích khí oxi cần dùng (đktc)Bài tập 3:Đốt cháy lưu huỳnh (S) trong oxi không khí thu được 6,4g lưu huỳnh đioxit (SO2 ).a. Viết PTHH của phản ứng xảy ra?b. Tính khối lượng của lưu huỳnh đã tham gia?c. Tính thể tích khí oxi cần trong phản ứng trên?d. Thể tích không khí đã dùng ở phản ứng trên? (Thể tích các khí đo ở đktc)Bài tập 4: Phân loại và gọi tên các oxit sau: CO2, HgO,...
Đọc tiếp
Bài tập 2:
Đốt cháy sắt trong khí oxi, sau phản ứng thu được 11,6g oxit sắt từ Fe3O4
a. Viết PTHH
b. Tính thể tích khí oxi cần dùng (đktc)
Bài tập 3:
Đốt cháy lưu huỳnh (S) trong oxi không khí thu được 6,4g lưu huỳnh đioxit (SO2 ).
a. Viết PTHH của phản ứng xảy ra?
b. Tính khối lượng của lưu huỳnh đã tham gia?
c. Tính thể tích khí oxi cần trong phản ứng trên?
d. Thể tích không khí đã dùng ở phản ứng trên? (Thể tích các khí đo ở đktc)
Bài tập 4: Phân loại và gọi tên các oxit sau:
CO2, HgO, MgO, FeO, N2O, Li2O, SO3, CaO, CO, BaO; P2O5 ;Na2O; NO2 , Al2O3, ZnO
bài tập 2
3Fe + 2O2 -\(-^{t^o}->\) Fe3O4 (1)
ADCT n= m/M
\(n_{fe_3O_4}\)= 11,6/ 232= 0,05 mol
Theo pt(1) có
\(\dfrac{n_{O2}}{n_{Fe3O4}}\)=\(\dfrac{2}{1}\)
-> \(n_{O2}\)= 2/1 x \(n_{fe3o4}\)
= 0,1 mol
ADCT V= n x 22,4
Vo2= 0,1 x 22,4
= 2,24 (l)
Đúng 1
Bình luận (0)
bài tập 4
OXIT AXIT:
- CO2: Cacbon đi oxit
- N2O: đi ni tơ oxit
- SO3: Lưu huỳnh tri oxit
- CO: cacbon oxit
P2O5: đi photpho penta oxit
NO2: Nitơ đi oxit
OXIT BA ZƠ
- HgO: thủy ngân (II) oxit
- MgO: Magie oxit
- FeO: sắt (II) oxit
- Li2O: liti oxit
-CaO: canxi oxit
- BaO: bari oxit
- Na2O: natri oxit
- Al2O3 : Nhôm oxit
ZnO: kẽm oxit
Đúng 0
Bình luận (0)
Bổ sung bài 3:
\(a,n_{SO_2}=\dfrac{6,4}{64}=0,1\left(mol\right)\\ PTHH:S+O_2\underrightarrow{t^o}SO_2\\ \left(mol\right)..0,1...0,1\leftarrow0,1\\ b,m_S=0,1.32=3,2\left(g\right)\\ c,V_{O_2}=0,1.22,4=2,24\left(l\right)\\ d,V_{kk}=5.V_{O_2}=5.2,24=11,2\left(l\right)\)
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Đốt cháy 32g lưu huỳnh trong khí oxi thu được 64 g khí luu huỳnh đioxit.
Khối lượng khí oxi cần dùng là
Theo ĐLBTKL: mS + mO2 = mSO2
=> mO2 = 64-32 = 32(g)
Đúng 1
Bình luận (0)
Để điều chế 7,2 lít khí Oxi trong phòng thí nghiệm điều kiện chuẩn người ta cần dùng a) bao nhiêu gam Kali clorat b) dùng lượng oxy trên Để đốt cháy lưu hành tính thể tích khí thu được (đkc)
a)$n_{O_2} = \dfrac{7,2}{24,79} = 0,29(mol)$
$2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2$
$n_{KClO_3} = \dfrac{2}{3}n_{O_2} = \dfrac{29}{150}(mol)$
$m_{KClO_3} = \dfrac{29}{150}.122,5 = 23,683(gam)$
b) $S + O_2 \xrightarrow{t^o} SO_2$
$V_{SO_2} = V_{O_2} = 7,2(lít)$
Đúng 2
Bình luận (0)
Lưu huỳnh cháy theo sơ đồ phản ứng sau :
Lưu huỳnh + khí oxi → khí sunfuro
Nếu đốt cháy 48 gam lưu huỳnh và thu được 96 gam khí sunfuro thì khối lượng của oxi tham gia phản ứng là bao nhiêu?
Áp dụng định luật bảo toàn khối lượng, ta có :
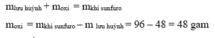
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn 6,72 gam kim loại sắt trong lọ đựng khí oxi
a. Viết phương trình phản ứng.
b. Tính thể tích khí oxi cần dùng ở điều kiện tiêu chuẩn.
c. Để điều chế được lượng khí oxi tham gia phản ứng trên, trong phòng thí nghiệm cần dùng bao nhiêu kali clorat.
(Fe:56; O:16; K:39; Cl:35,5; H:1; Zn:65)
Mọi người giúp mình với ạ.
a.b.\(n_{Fe}=\dfrac{6,72}{56}=0,12mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,12 0,08 ( mol )
\(V_{O_2}=0,08.22,4=1,792l\)
c.\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
4/75 0,08 ( mol )
\(m_{KClO_3}=\dfrac{4}{75}.122,5=6,533g\)
Đúng 3
Bình luận (1)
nFe = 6,72 : 56 = 0,12 (mol)
pthh : 3Fe + 2O2 -t--> Fe3O4
0,12 --> 0,08 (mol)
=> VO2 = 0,08 . 22,4 = 1,792 (L)
pthh: 2KClO3 -t--> 2KCl + 3O2
0,053<------------------ 0,08 (mol)
=> mKClO3 = 0,053 . 122,5 = 6,53 (G)
Đúng 2
Bình luận (0)


























