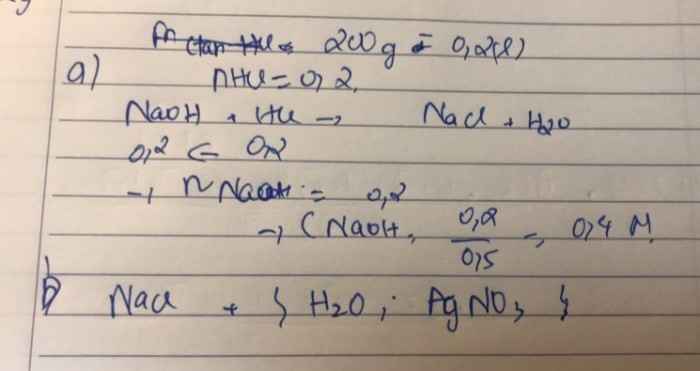Trung hòa 200 gam dd NaOH nồng độ 10% bằng dd HCl . Tính nồng độ % chất tan trong dd sau pư

Những câu hỏi liên quan
Hòa tan hoàn toàn 2,4 gam Fe vào dd HCl 14,6%. Tính khối lượng dd HCl đã dùng? Tính nồng độ phần trăm dd sau pư?
Sửa thành 2,24 gam cho số đẹp bạn nhé!
Ta có: \(n_{Fe}=\dfrac{2,24}{56}=0,04\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
___0,04__0,08____0,04__0,04 (mol)
Ta có: \(m_{HCl}=0,08.36,5=2,92\left(g\right)\)
\(\Rightarrow m_{ddHCl}=\dfrac{2,92}{14,6\%}=20\left(g\right)\)
Ta có: m dd sau pư = mFe + m dd HCl - mH2 = 2,24 + 20 - 0,04.2 = 22,16 (g)
\(\Rightarrow C\%_{FeCl_2}=\dfrac{0,04.127}{22,16}.100\%\approx22,9\%\)
Bạn tham khảo nhé!
Đúng 2
Bình luận (0)
Hòa tan 32g sắt (III) oxit vào 218g dd HCl 30%. Tính nồng độ C% của các chất trong dd sau pư
Số mol của sắt (III) oxit
nFe2O3 = \(\dfrac{m_{Fe2O3}}{M_{Fe2O3}}=\dfrac{32}{160}=0,2\left(mol\right)\)
Khối lượng của axit clohidric
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{30.218}{100}=65,4\left(g\right)\)
Số mol của axit clohidric
nHCl = \(\dfrac{m_{HCl}}{M_{HCl}}=\dfrac{65,4}{36,5}=1,8\left(mol\right)\)
Pt : Fe2O3 + 6HCl → 2FeCl3 + 3H2O\(|\)
1 6 2 3
0,2 1,8 0,4
Lập tỉ số so sánh : \(\dfrac{0,2}{1}< \dfrac{1,8}{6}\)
⇒ Fe2O3 phản ứng hết , HCl dư
⇒ Tính toán dựa vào số mol của Fe2O3
Số mol của sắt (III) clorua
nFeCl3 = \(\dfrac{0,2.2}{1}=0,4\left(mol\right)\)
Khối lượng của sắt (III) clorua
mFeCl3 = nFeCl3 . MFeCl3
= 0,4. 162,5
= 65 (g)
Số mol dư của dung dịch axit clohidric
ndư= nban đầu -nmol
= 1,8 - \(\left(\dfrac{0,2.6}{1}\right)\)
= 0,6 (mol)
Khối lượng dư của dung dịch axit clohidric
mdư = ndư . MHCl
= 0,6 . 36,5
= 21,9 (g)
Khối lượng của dung dịch sau hản ứng
mdung dịch sau phản ứng = mFe2O3 + mHCl
= 32 + 218
= 250 (g)
Nồng độ phần trăm của sắt (III) clorua
C0/0FeCl3 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{65.100}{250}=26\)0/0
Nồng độ phần trăm của dung dịch axit clohidric
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{21,9.100}{250}=8,76\)0/0
Chúc bạn học tốt
Đúng 1
Bình luận (0)
hòa tan hết 95.9 gam bari vào 200 gam dung dịch hcl a%sau pư thu đc dd A có nồng độ của muối là 35.31415%.tính giá trị a và số mol mỗi chất tan cos trong dung dịch a
hòa tan 11,5 g na vào 500 g dd naoh có nồng độ 8% thu đc dd A.a, tính nồng độ % chất tan trong dd thu đc.b,để trung hòa dd A cần dùng bn ml dd X chứa đồng thời hcl 1M và h2so4 0,5M
a) \(n_{Na}=\dfrac{11,5}{23}=0,5\left(mol\right)\)
\(n_{NaOH}=\dfrac{8\%.500}{40}=1\left(mol\right)\)
\(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\)
0,5---------------->0,5------->0,25
\(\Sigma n_{NaOH}=0,5+1=1,5\left(mol\right)\)
\(m_{ddsaupu}=11,5+500-0,25.2=511\left(g\right)\)
=> \(C\%_{NaOH}=\dfrac{1,5.40}{511}.100=11,74\%\)
b) Gọi thể tích dung dịch X cần tìm là V
\(n_{H^+}=V.1+V.0,5.1=2V\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
Ta có : \(n_{H^+}=n_{OH^-}=1,5\left(mol\right)\)
=> 2V=1,5
=> V=0,75(lít)
Đúng 2
Bình luận (0)
Trung hòa 500 ml dd NaOH bằng 200 g dd HCL 0,1M
a) Tính nồng độ mol/lít của dd NaOH
b) Muối thu được ở trên tác dụng với những chất nào sau đây:
H2O, AgNO3, HNO3
Sửa đề 200ml dd HCl
\(a,n_{HCl}=0,2.0,1=0,02\left(mol\right)\)
PTHH: \(NaOH+HCl\rightarrow NaCl+H_2O\)
0,02<----0,02
\(C_{M\left(NaOH\right)}=\dfrac{0,02}{0,5}=0,04M\)
b) Muối thu được là NaCl phản ứng được với H2O, AgNO3
\(2NaCl+2H_2O\xrightarrow[\text{có màng ngăn}]{\text{điện phân}}2NaOH+Cl_2\uparrow+H_2\uparrow\\ NaCl+AgNO_3\rightarrow AgCl\downarrow+NaNO_3\)
Đúng 1
Bình luận (0)
Cho 200 ml dd NaOH 0,5M tác dụng với 300 ml dd HCl 1M. Sau pư thu được dd A. Tính:
a/ Khối lượng muối tạo thành? b/ Nồng độ mol các chất trong dd A?
a) \(NaOH+HCl\rightarrow NaCl+H_2O\)
0,1................0,3
LẬp tỉ lệ : \(\dfrac{0,1}{1}< \dfrac{0,3}{1}\)=> Sau pứ HCl dư
\(m_{NaCl}=0,1.58,5=5,85\left(g\right)\)
b) \(CM_{NaCl}=\dfrac{0,1}{0,2+0,3}=0,2M\)
\(CM_{HCl\left(dư\right)}=\dfrac{\left(0,3-0,1\right)}{0,2+0,3}=0,4M\)
Đúng 2
Bình luận (0)
Hòa tan hoàn toàn 4,55g kim loại Zn vào 200 mL dd HCl (khối lượng riêng là 0,8 g/ml), sau PƯ thu đc V lít khí (đktc) và dd X
a) Tính nồng độ mol dd HCl tham gia PƯ
b) Tính giá trị V
c) Cô cạn dd X hoàn toàn, tính khối lượng chất rắn còn lại
d) Cho dd X PƯ đủ với 200g dd AgNO3, thu đc ddY. Tính nồng độ % dd Y
(Cho Zn=65, Cl=35.5, H=1)
\(n_{Zn}=\dfrac{4,55}{65}=0,07(mol)\\ Zn+2HCl\to ZnCl_2+H_2\\ a,n_{HCl}=0,14(mol)\\ \Rightarrow C_{M_{HCl}}=\dfrac{0,14}{0,2}=0,7M\\ b,n_{H_2}=0,07(mol)\\ \Rightarrow V_{H_2}=0,07.22,4=1,568(l)\\ c,n_{ZnCl_2}=0,07(mol)\\ \Rightarrow m_{ZnCl_2}=0,07.136=9,52(g)\\ c,ZnCl_2+2AgNO_3\to 2AgCl\downarrow+Zn(NO_3)_2\)
\(m_{dd_{ZnCl_2}}=200.0,8+4,55-0,07.2=164,41(g)\\ n_{AgCl}=0,14(mol);n_{Zn(NO_3)_2}=0,07(mol)\\ \Rightarrow C\%_{Zn(NO_3)_2}=\dfrac{0,07.189}{164,41+200-0,14.143,5}.100\%=3,84%\)
Đúng 3
Bình luận (0)
Cho 7,2 gam Mg vào 200 gam dd HCl 14,6% đc dd A.
1. tính thể tích dd KOH 2M cần dùng để trung hòa dd A
2. tính nồng độ % từng chất trong dd A
\(n_{Mg}=\dfrac{7.2}{24}=0.3\left(mol\right)\)
\(n_{HCl}=\dfrac{200\cdot14.6\%}{36.5}=0.8\left(mol\right)\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(0.3.........0.6.........0.3..........0.3\)
\(n_{HCl\left(dư\right)}=0.8-0.6=0.2\left(mol\right)\)
\(KOH+HCl\rightarrow KCl+H_2O\)
\(0.2........0.2\)
\(V_{dd_{KOH}}=\dfrac{0.2}{2}=0.1\left(l\right)\)
\(m_{\text{dung dịch sau phản ứng}}=7.2+200-0.3\cdot2=206.6\left(g\right)\)
\(m_{MgCl_2}=0.3\cdot95=28.5\left(g\right)\)
\(C\%MgCl_2=\dfrac{28.5}{206.6}\cdot100\%=13.8\%\)
\(C\%HCl\left(dư\right)=\dfrac{0.2\cdot36.5}{206.6}\cdot100\%=3.53\%\)
Đúng 2
Bình luận (0)
cho 9,2 gam kim lọai hóa trị I vào dd HCl 14,6% đc dd A. Để trung hòa dd A cần 200 gam dd Ba(OH)2 17,1% đc dd B. Cô cạn dd B đc 65 gam muối khan. Xác định tên kim lọai và tính nồng độ % từng chất tan trong dd A
Gọi kim loại cần tìm là R
n Ba(OH)2 = 0,2(mol)
=> n BaCl2 = 0,2(mol)
=> m RCl = 65 - 0,2.208 = 23,4(gam)
Mặt khác :
n R = n RCl
<=> 9,2/R = 23,4/(R + 35,5)
<=> R = 23(Natri)
n H2 = 1/2 n Na = 0,2(mol)
n HCl dư = 2 n Ba(OH)2 = 0,4(mol)
n HCl đã dùng = n NaCl + n HCl dư = 0,4 + 0,4 = 0,8(mol)
=> m dd HCl = 0,8.36,5/14,6% = 200(gam)
=> m dd A = 9,2 + 200 - 0,2.2 = 208,8(gam)
C% HCl = 0,4.36,5/208,8 .100% = 7%
C% NaCl = 23,4/208,8 .100% = 11,2%
Đúng 4
Bình luận (0)