Dựa vào đâu để điều chỉnh độ pH của dung dịch dinh dưỡng?
A. Dùng máy đo pH
B. Dùng dung dịch H 2 S O 4
C. Tất cả phương án trên đều đúng
D. Tất cả phương án trên đều sai
Câu 1: Pha loãng dung dịch 1 lít NaOH có pH=9 bằng nước để được dung dịch mới có pH=8. Thể tích nước cần dùng là? A.5 lít B.4 lít. C.9 lít D.10 lít.
Câu 2: Để trung hòa 40 ml dung dịch H2SO4 0,25M cần 50 ml dung dịch NaOH nồng độ xmol/l.Giá trị của x là? A.0,1 B.0,2 C.0,3 D.0,4.
Giải thích các bước giải:
pH = 9 → [H+] = 10−9(M)
[H+].[OH-]=10−14
→ [OH-] = 10−5(M)
→ nOH- = 10−5 . 1 = 10−5(mol)
pH=8 → [H+] = 10−8(M)
[H+].[OH-]=10−14
→ [OH-] = 10−6(M)
Gọi x lít là thể tích nước cần dùng
Ta có
\(\dfrac{10^{-5}}{x+1}\)= 10-6
→x=9
Chọn câu C.9 lít
1 Pha loãng dung dịch HCl có pH = 3 bao nhiêu lần để được dung dịch mới có pH = 4 ?
2 Pha loãng dung dịch 1 lít NaOH có pH = 9 bằng nước để được dung dịch mới có pH = 8. Thể tích nước cần dùng là?
Câu 1 :
Gọi thể tích dung dịch ban đầu là V(lít)
$[H^+] = 10^{-3}V(mol)$
Thể tích dung dịch lúc sau là :
$V' = \dfrac{10^{-3}.V}{10^{-4}} = 10V$
Do đó cần pha loãng dung dịch ban đầu 10 lần thì thu được dung dịch trên
Câu 2 :
$[OH^-] = 10^{-14} : 10^{-9} = 10^{-5}M$
$n_{OH^-} = 10^{-5}.1 = 10^{-5}(mol)$
Sau khi pha :
$[OH^-] = 10^{-14} : 10^{-8} = 10^{-6}M$
$V_{dd} = \dfrac{10^{-5}}{10^{-6}} = 0,1(lít) = 100(ml)$
$V_{nước\ cần\ dùng} = 1000 - 100 = 900(ml)$
Thêm từ từ 100g dd H2SO4 98% vào nước và điều chỉnh để được 1 lít dung dịch X. Phải thêm vào 1 lít dung dịch X bao nhiêu lít dung dịch NaOH 1,5M để thu được dung dịch có pH = 13?
A. 1,24 lít
B. 1,50 lít
C. 1,14 lít
D. 3,00M.
Thêm từ từ 100g dd H2SO4 98% vào nước và điều chỉnh để được 1 lít dung dịch X. Phải thêm vào 1 lít dung dịch X bao nhiêu lít dung dịch NaOH 1,5M để thu được dung dịch có pH = 13?
A. 1,24 lít
B. 1,50 lít
C. 1,14 lít
D. 3,00M.
Có 4 ống nghiệm mất nhãn, mỗi ống đựng một trong các khí H 2 , HCl , NH 3 , CH 4 , CO 2 , O 2 , với thể tích như nhau. Đánh số các ống nghiệm rồi úp ngược trên các chậu đựng nước, để yên một thời gian rồi dùng máy đo pH của các dung dịch thu được kết quả như hình vẽ :
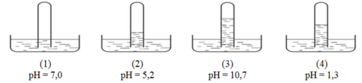
Chọn khẳng định nào sau đâu là đúng ?
A. Khi thêm vài giọt phenolphtalein vào chậu (3) thì dung dịch chuyển sang màu xanh.
B. Khi thêm vài giọt dung dịch H 2 SO 4 vào chậu (3) thì mực nước trong ống nghiệm (3) sẽ dâng lên.
C. Khi cho khí trong ống nghiệm ở chậu (2) tiếp xúc với khí trong ống nghiệm ở chậu (4) sẽ xuất hiện khói trắng.
D. Khi thêm vài giọt dung dịch NaOH vào chậu (2) thì mực nước trong ống nghiệm (2) sẽ hạ xuống.
Đáp án B
Dựa vào kết quả thí nghiệm, ta thấy : Khí trong ống nghiệm ở chậu (1) không tan trong nước; khí trong ống nghiệm ở chậu (2) tan ít trong nước làm cho nước ở trong chậu dâng lên ống nghiệm một chút, dung dịch trong chậu có tính axit; khí trong ống nghiệm ở chậu (3) tan nhiều trong nước nhất, làm cho nước dâng vào ống nghiệm cao nhất, dung dịch trong chậu có tính bazơ; khí trong ống nghiệm ở chậu (4) tan ít hơn khí ở ống nghiệm (3), nhưng tan nhiều hơn khí ở ống nghiệm (2), dung dịch trong chậu có tính axit mạnh.
Khi thêm vài giọt dung dịch NaOH vào chậu (2) thì lượng axit bị giảm. Suy ra khí trong ống nghiệm ở chậu (2) tan thêm vào nước nên mực nước trong ống nghiệm sẽ dâng cao hơn.
Chậu (3) có tính bazơ nên khi cho phenolphtalein vào thì dung dịch chuyển sang màu xanh.
Khí trong ống nghiệm ở chậu (2) và chậu (4) khi tan vào nước đều cho dung dịch axit nên không thể phản ứng với nhau tạo khói trắng.
Khi cho thêm vài giọt dung dịch H 2 SO 4 vào chậu (3) thì lượng bazơ bị giảm. Suy ra khí trong ống nghiệm tan thêm vào nước nên mực nước trong ống nghiệm sẽ dâng cao hơn.
Vậy đáp án đúng là "Khi thêm vài giọt dung dịch H 2 SO 4 vào chậu (3) thì mực nước trong ống nghiệm (3) sẽ dâng lên"
Có 4 ống nghiệm mất nhãn, mỗi ống đựng một trong các khí H2, HCl, NH3, CH4, CO2, O2, với thể tích như nhau. Đánh số các ống nghiệm rồi úp ngược trên các chậu đựng nước, để yên một thời gian rồi dùng máy đo pH của các dung dịch thu được kết quả như hình vẽ :
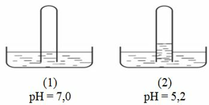
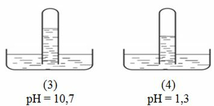
Chọn khẳng định nào sau đâu là đúng ?
A. Khi thêm vài giọt phenolphtalein vào chậu (3) thì dung dịch chuyển sang màu xanh
B. Khi thêm vài giọt dung dịch H2SO4 vào chậu (3) thì mực nước trong ống nghiệm (3) sẽ dâng lên
C. Khi cho khí trong ống nghiệm ở chậu (2) tiếp xúc với khí trong ống nghiệm ở chậu (4) sẽ xuất hiện khói trắng
D. Khi thêm vài giọt dung dịch NaOH vào chậu (2) thì mực nước trong ống nghiệm (2) sẽ hạ xuống
Chọn B
Khi thêm vài giọt dung dịch H2SO4 vào chậu (3) thì mực nước trong ống nghiệm (3) sẽ dâng lên
Dung dịch chưa bão hòa và dung dịch bão hòa :
Mô tả cách tiến hành thì nghiệm để :
- Chuyển dung dịch muối ăn chưa bão hòa thành dung dịch muối ăn bão hòa ( ở nhiệt độ phòng )
- Chuyển dung dịch muối ăn bão hòa thành dung dịch muối ăn chưa bão hòa ( ở nhiệt độ phòng )
Để trung hòa hết 9,25 g hidroxit của kim loại hóa trị II cần dùng 50 g dd H2SO4 24,5%.
a. Tìm CTHH của bazơ.
b. Tính C% của dung dịch muối thu được.
7) Cho 7,4 g dung dịch Ca(OH)2 5% vào 750 ml dung dịch HCl 1 M.
a. pH của dung dịch nằm trong khoảng nào?
b. Tính khối lượng muối sinh ra.
Bài 1:
Gọi kim loại cần tìm là R
\(\Rightarrow n_{R\left(OH\right)_2}=\dfrac{9,25}{M_R+34}\left(mol\right)\\ m_{H_2SO_4}=\dfrac{50\cdot24,5\%}{100\%}=12,25\left(g\right)\\ \Rightarrow n_{H_2SO_4}=\dfrac{12,25}{98}=0,125\left(mol\right)\\ PTHH:R\left(OH\right)_2+H_2SO_4\rightarrow RSO_4+2H_2O\\ \Rightarrow n_{R\left(OH\right)_2}=n_{H_2SO_4}=0,125\left(mol\right)\\ \Rightarrow\dfrac{9,25}{M_R+34}=0,125\\ \Rightarrow M_R+34=74\\ \Rightarrow M_R=40\)
Vậy R là Canxi (Ca) và CTHH của Bazo là \(Ca\left(OH\right)_2\)
\(b,PTHH:Ca\left(OH\right)_2+H_2SO_4\rightarrow CaSO_4+2H_2O\\ \Rightarrow n_{CaSO_4}=0,125\left(mol\right);n_{H_2}=0,25\left(mol\right)\\ \Rightarrow\left\{{}\begin{matrix}m_{CaSO_4}=0,125\cdot136=17\left(g\right)\\m_{H_2}=0,25\cdot2=0,5\left(g\right)\end{matrix}\right.\\ \Rightarrow m_{dd_{CaSO_4}}=9,25+50-0,5=58,75\left(g\right)\\ \Rightarrow C\%_{CaSO_4}=\dfrac{17}{58,75}\cdot100\%\approx28,94\%\)
a,Theo đề ta có: C% H2SO4= 24,5% và 50g dung dịch H2SO4 ( m dung dịch)
=> m H2SO4 = C%x mdd/100%=24.5% x 50/ 100%=12.25(g)
=> n H2SO4 = 12.25 : 98 = 0.125 ( mol)
Gọi công thức hidroxit của kl hóa trị II là X( OH)2 ta được:
PTHH : X(OH)2 + H2SO4 -> XSO4 + 2H2O
đb : 0,125 < - 0,125 ( mol)
theo pt ta có : n X(OH)2 = 0,125 (mol) => M X(OH)2 = m :n = 9,25 : 0,125= 74( mol/ gam)
=> X= 74- ( 16 x 2 + 1x2) = 74 -34 = 40
-> X là Canxi ( Ca) => CTHH của hidroxit đó là Ca( OH)2.