Muốn điều chế được 6,72 lít khí Cl 2 (đktc) thì khối lượng K 2 Cr 2 O 7 tối thiểu cần lấy để cho tác dụng với dung dịch HCl đặc, dư là
A. 26,4 g
B. 27,4 g
C. 28,4 g
D. 29,4 g
PTHH : \(2KClO_3\rightarrow t^0\rightarrow2KCl+3O_2\uparrow\)
Số mol KClO3 tham gia phản ứng : \(n_{KClO_3}=\frac{m_{KClO_3}}{M_{KClO_3}}=\frac{12,25}{122,5}=0,1\left(mol\right)\)
1. Theo PTHH : Cứ 2 mol KClO3 tham gia phản ứng thì tạo thành 3 mol O2
=> Cứ 0,1 mol KClO3 tham gia phản ứng thì tạo thành 0,15 mol O2
=> Thể tích khí O2 thu được ở đktc là : \(V_{O_2}=n_{O_2}\times22,4=0,15\times22,4=3,36\left(l\right)\)
2. Số mol O2 tạo thành sau phản ứng : \(n_{O_2}=\frac{m_{O_2}}{M_{O_2}}=\frac{48}{32}=1,5\left(mol\right)\)
Theo PTHH : Cứ 3 mol O2 tạo thành sau phản ứng thì có 2 mol KClO3 tham gia phản ứng
=> Cứ 1,5 mol O2 tạo thành sau phản ứng thì có 1 mol KClO3 tham gia phản ứng
=> Khối lượng KClO3 cần nhiệt phân : \(m_{KClO_3}=n_{KClO_3}\times M_{KClO_3}=1\cdot126,9=126,9\left(g\right)\)
3. Số mol O2 thu được sau phản ứng ở đktc : \(n_{O_2}=\frac{V_{O_2}}{22,4}=\frac{2,8}{22,4}=0,125\left(mol\right)\)
Theo PTHH : Cứ 3 mol O2 tạo thành sau phản ứng thì có 2 mol KClO3 tham gia phản ứng
=> Cứ 0.125 mol O2 tạo thành sau phản ứng thì có 1/12 mol KClO3 tham gia phản ứng
=> Khối lượng KClO3 cần nhiệt phân : \(m_{KClO_3}=n_{KClO_3}\times M_{KClO_3}=\frac{1}{12}\cdot126,9=10.575\left(g\right)\)
Quỳnh•Sinestrea⁰⁷ : đừng làm hóa nữa, làm toàn nhầm thôi đấy
1. PTHH : \(2KClO_3-t^o->2KCl+3O_2\)
. \(n_{KClO_3}=\frac{12,25}{122,5}=0,1\left(mol\right)\)
Theo pthh : \(n_{O_2}=\frac{3}{2}n_{KClO_3}=0,15\left(mol\right)\)
=> \(V_{O_2}=0,15\cdot22,4=3,36\left(l\right)\)
2. PTHH : \(2KClO_3-t^o->2KCl+3O_2\)
\(n_{O_2}=\frac{48}{32}=1,5\left(mol\right)\)
Theo pthh : \(n_{KClO_3}=\frac{2}{3}n_{O_2}=1\left(mol\right)\)
=> \(m_{KClO_3}=1\cdot122,5=122,5\left(g\right)\)
3. PTHH : \(2KMnO_4-t^o->K_2MnO_4+MnO_2+2O_2\)
\(n_{O_2}=\frac{2,8}{22,4}=0,125\left(mol\right)\)
Theo pthh : \(n_{KMnO_4}=n_{O_2}=0,125\left(mol\right)\)
=> \(m_{KMnO_4}=0,125\cdot158=19,75\left(g\right)\)
Câu 1. Muốn điều chế được 4,48 lít khí oxi (đktc) thì khối lượng KMnO4 cần nhiệt phân là bao nhiêu? (Cho nguyên tử khối: O = 16, K = 39, Mn = 55)
Câu 2. Đốt cháy 6,2 gam photpho với 6,4 gam oxi trong không khí, sản phẩm thu được là điphotpho pentaoxit (P2O5).
a. Viết PTHH của phản ứng.
b. Sau phản ứng chất nào còn dư và số mol chất còn dư là bao nhiêu?
b. Tính khối lượng sản phẩm tạo thành.
C1:
nO2 = 4,48/22,4 = 0,2 (mol)
PTHH: 2KMnO4 -> (t°) K2MnO4 + MnO2 + O2
nKMnO4 = 0,2 . 2 = 0,4 (mol)
mKMnO4 = 0,4 . 158 = 63,2 (g)
C2:
nP = 6,2/31 = 0,2 (mol)
nO2 = 6,4/32 = 0,2 (mol)
PTHH: 4P + 5O2 -> (t°) 2P2O5
LTL: 0,2/4 > 0,2/5 => P dư
nP2O5 = 0,2/5 . 2 = 0,08 (mol)
mP2O5 = 0,08 . 142 = 11,36 (g)
1. Nhiệt phân hoàn toàn 12,25g KClO3. Tính thể tích khí O2 ( ở đktc) thu được ?
2. Muốn điều chế được 48 g O2 thì khối lượng KClO3 cần nhiệt phân là bao nhiêu g ?
3. Muốn điều chế được 2,8 lít O2 (ở đktc) thì khối lượng KMnO4 cần nhiệt phân là bao nhiêu ?
4. Trong phòng thí nghiệm, người ta điều chế oxit sắt từ Fe3O4 bằng cách dùng O2 oxi hóa sắt ở nhiệt độ cao. Để điều chế được 2,32g Fe3O4 cần dùng :
a/ Bao nhiêu gam sắt ?
b/ Bao nhiêu lít khí O2 ( ở đktc) :
5. Đốt cháy 1kg than trong khí O2, biết trong than có 10% tạp chất không cháy.Tính:
a. thể tích oxi (đktc) cần thiết để đốt cháy 1kg than trên.
b. thể tích khí cacbonic CO2 (đktc) sinh ra trong phản ứng trên
6. Người ta dùng đèn xì oxi –axetilen để hàn cắt kim loại. Phản ứng cháy của axetilen C2H2 trong oxi tạo thành khí cacbonic và hơi nước. Hãy tính thể tích oxi (đktc) cần thiết để đốt cháy 1mol C2H2
7. Đốt cháy hoàn toàn 5,4g nhôm. Tính :
a. thể tích khí O2 (đktc) cần dùng ?
b. số gam KMnO4 cần dùng để điều chế lượng khí O2 trên ?
8. Xác định công thức hóa học của nhôm oxit, biết tỉ lệ khối lượng của 2 nguyên tố nhôm và oxi bằng 4,5 : 4.
9. Một oxit của lưu huỳnh trong đó oxi chiếm 60% về khối lượng. Tìm công thức phân tử của oxit đó?
10. Cho 5,6 g sắt vào 100 ml dung dịch HCl 1M . Hãy:
a) Tính lượng khí H2 tạo ra ở đktc?
b) Chất nào còn dư sau phản ứng và lượng dư là bao nhiêu?
c) Tính nồng độ các chất sau phản ứng?
11. Nếu đốt cháy 13,5g nhôm trong một bình kín chứa 6,72 lít oxi (ở đktc) tạo thành nhôm oxit Al2O3 thì :
a/ Chất nào còn dư sau phản ứng? Số gam chất dư ?
b/ Tính khối lượng Al2O3 tạo thành?
12. Đốt cháy 6,2g photpho trong bình kín chứa 7,84 lít oxi (ở đktc) tạo thành điphotpho pentaoxit P2O5 thì
a/ Chất nào còn dư sau phản ứng? Số gam chất dư ?
b/ Tính khối lượng P2O5 tạo thành?
13. Cho 28,4g điphotpho pentaoxit P2O5 vào cốc chứa 90g nước để tạo thành axit photphoric. Tinh khối lượng axit H3PO4 được tạo thành ?
Em tách ra mỗi bài đăng 1 lượt nha!
Muốn điều chế 6,72 lít khí clo ở đktc thì khối lượng K 2 Cr 2 O 7 tối thiều cần dùng đế tác dụng với dung dịch HCl đặc, dư là
A. 29,4 gam
B. 27,4 gam
C. 24,9 gam
D. 26,4 gam
Đáp án A
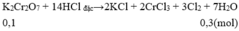
→ m K 2 Cr 2 O 7 = 0,1.294 = 29,4 gam
Câu 3: K = 39; Cl = 35,5; O = 16. Trong phòng thí nghiệm để điều chế được 6,72 lít oxi (đktc) thì cần bao nhiêu gam Kali clorat (KClO3): *
nO2=6,72/22,4=0,3(mol)
PTHH: 2 KClO3 -to->2 KCl +3 O2
Ta có: nKClO3=2/3. 0,3=0,2(mol)
=>mKClO3=0,2.122,5=24,5(g)
tính khối lượng KCLO3 đã bị nhiệt phân, biết rằng thể tích khí oxi thu được sau phản ứng là 6,72 lít (ở đktc) (biết K:39; Cl:35,5; O:16
nO2=6,72/22,4=0,3 mol
PTPƯ: 2KClO3 Nhiệt Phân→ 2KCl + 3O2↑
0,3 mol O2 ---> 0,2 mol KClO3
nên mKClO3=122,5.0,2=24,5 g
Câu 25: Muốn điều chế được 3,36 lít khí oxi (đktc) thì khối lượng KMnO4 cần nhiệt phân là bao nhiêu? (Cho: O = 16, K = 39, Mn = 55)
A.23,7 gam.
B.47,4 gam.
C.42,4 gam
D. 24,7 gam.
Câu 26: Đốt cháy 12,4g photpho trong bình chứa 17g khí oxi tạo thành điphotpho pentaoxit P2O5. Khối lượng sản phẩm tạo thành là (Cho: P = 31, O = 16)
A.56,8 gam.
B.42,6 gam.
C.71 gam.
D.28,4 gam.
Câu 27: Cho 4,7 gam K2O tác dụng hoàn toàn với H2O theo phản ứng.
K2O + H2O ---[Math Processing Error]→ KOH
Khối lượng KOH thu được sau phản ứng là: (Cho: K = 39, O = 16, H = 1)
A.6,5 gam.
B.6 gam.
C.5 gam.
D.5,6 gam.
cho 10 lít khí H2 tác dụng với 6,72 lít Cl2 (đktc). Tính khối lượng HCl thu được, biết hiệu suất phản ứng là 60% và mất mát là 5%.
Em kiểm tra lại đề nhé. Dữ kiện mất mát 5% hơi mẫu thuẫn. Vì hiệu suất có là 60% nên lượng mất mát đã là 40% rồi
Muốn điều chế được 3,36 lít khí Cl2 (đktc) thì khối lượng K2Cr2O7 tối thiểu cần lấy để cho tác dụng với dung dịch HCl đặc, dư là
A. 13,2g
B. 13,7g
C. 14,2g
D. 14,7g
Đáp án : D
2Cr+6 + 6e -> 2Cr+3
2Cl- -> Cl2 + 2e
Bảo toàn e: nCl2.2 = 6nK2Cr2O7
=> nK2Cr2O7 = 0,05 mol
=> mK2Cr2O7 =14,7g