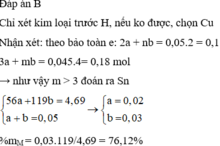Cho một lượng oxit kim loại M tác dụng với khí H2 dư thu được 1,68 gam kim loại và 0,72 gam H2O. Hoà tan lượng kim loại trên vào dung dịch HCl dư thu được 0,672 lí khí H2 (đktc). Xác địn CTHH của oxit đem dùng

Những câu hỏi liên quan
9. Khử 3,48 gam oxit một kim loại M cần dùng 1,344 lít CO (đktc). Toàn bộ lượng kim loại thu được cho tác dụng với dung dịch HCl dư thu được 1,008 lít H2 (đktc). Xác định kim loại M và oxit của nó.
Gọi CT oxit là M2Om
Mol H2 TN1=0,06 mol
Mol H2 TN2=0,045 mol
M2Om + mH2→ 2M + mH2O
0,06/m mol<=0,06 mol. =>0,12/m mol
=>0,06(2M+16m)/m=3,48
2M + 2nHCl→ 2MCln + nH2
0,12/m mol. 0,045 mol
⇒⇒0,045.2/n=0,12/m⇒⇒m=8/3; n=2 tm
Thay m=8/3 vào công thức tính m có M=56 FeFe
Oxit là Fe3O4 vì n=8/3
Đúng 1
Bình luận (10)
Chia hỗn hợp X gồm K, Al và Fe thành hai phần bằng nhau.- Cho phần 1 vào dung dịch KOH (dư) thu được 0,784 lít khí
H
2
(đktc).- Cho phần 2 vào một lượng dư
H
2
O
, thu được 0,448 lít khí
H
2
(đktc) và m gam hỗn hợp kim loại Y. Hoà tan hoàn toàn Y vào dung dịch HCl (dư) thu được 0,56 lít khí
H
2
(đktc). Tính khối lượng mỗi kim loại trong mỗi phần.
Đọc tiếp
Chia hỗn hợp X gồm K, Al và Fe thành hai phần bằng nhau.
- Cho phần 1 vào dung dịch KOH (dư) thu được 0,784 lít khí H 2 (đktc).
- Cho phần 2 vào một lượng dư H 2 O , thu được 0,448 lít khí H 2 (đktc) và m gam hỗn hợp kim loại Y. Hoà tan hoàn toàn Y vào dung dịch HCl (dư) thu được 0,56 lít khí H 2 (đktc). Tính khối lượng mỗi kim loại trong mỗi phần.
Để hoà tan 1,95 gam kim loại X cần dùng V ml dung dịch HCl và thu được 0,672 lít khí H 2 (ở đktc). Mặt khác nếu hoà tan 1,6 gam oxit của kim loại Y cũng cần dùng V ml dung dịch HCl ở trên. Xác định hai kim loại X và Y.
Thể tích dung dịch HCl dùng cho cả 2 phản ứng bằng nhau, nên có cùng số mol. Kí hiệu X, Y là khối lượng mol nguyên tử của 2 kim loại.
Phương trình hoá học của phản ứng :
2X + 2nHCl → 2X Cl n + n H 2 ↑
n H 2 = 0,672 /22,4 = 0,03 mol
Theo đề bài: 0,06/n x X = 1,95 → X = 32,5n
Kẻ bảng
| n | 1 | 2 | 3 |
| X | 32,5 | 65 | 97,5 |
Vậy X là Zn
Y 2 O m + mHCl → Y Cl m + m H 2 O
Theo đề bài, ta có:
(2Y + 16m) = 1,6 → Y = 56/3.m
Kẻ bảng
| m | 1 | 2 | 3 |
| Y | 56,3 | 112/3 | 56 |
Vậy Y là Fe.
Đúng 0
Bình luận (0)
Khử 3,48 gam một oxit kim loại M cần dùng 1,344 lít khí hiđro (ở đktc). Toàn bộ lượng kim loại thu được tác dụng với dung dịch HCl dư cho 1,008 lít khí hiđro (ở đktc). Xác định kim loại M và công thức hóa học của oxit trên?
CTHH: AxOy
\(n_{H_2}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
PTHH: AxOy + yH2 --to--> xA + yH2O
\(\dfrac{0,06}{y}\)<--0,06---->\(\dfrac{0,06x}{y}\)
2A + 2nHCl --> 2ACln + nH2
\(\dfrac{0,06x}{y}\)---------------->\(\dfrac{0,03xn}{y}\)
=> \(\dfrac{0,03xn}{y}=\dfrac{1,008}{22,4}=0,045\left(mol\right)\)
=> \(\dfrac{y}{x}=\dfrac{2}{3}n\)
\(M_{A_xO_y}=\dfrac{3,48}{\dfrac{0,06}{y}}=58y\left(g/mol\right)\)
=> \(x.M_A=42y\)
=> \(M_A=\dfrac{42y}{x}=28n\left(g/mol\right)\)
Xét n = 2 thỏa mãn => MA = 56 (g/mol)
=> A là Fe
\(\dfrac{x}{y}=\dfrac{3}{2n}=\dfrac{3}{4}\) => CTHH: Fe3O4
Đúng 4
Bình luận (0)
Cho V lít khí CO đktc đi qua ống sứ chứa 2,32g oxit sắt kim loại nung nóng đến phản ứng hoàn toàn thu được m gam kim loại và hỗn hợp khí có tỉ khối so với H2 bằng 18.Dẫn toàn bộ lượng khí này vào bình chứa 2000ml dung dịch Ca(OH)2 0,015M.Kết thúc phản ứng thu được 2g kết tủa và dung dịch A.Lọc tách kết tủa rồi cho dung dịch Ba(OH)2 dư vào dung dịch A ta thu được p gam kết tủa.Cho toàn bộ lượng kim loại thi được ở trên vào bình chứa dung dịch HCl dư,phản ứng kết thúc ta thu được 0,672 lít khí H2...
Đọc tiếp
Cho V lít khí CO đktc đi qua ống sứ chứa 2,32g oxit sắt kim loại nung nóng đến phản ứng hoàn toàn thu được m gam kim loại và hỗn hợp khí có tỉ khối so với H2 bằng 18.Dẫn toàn bộ lượng khí này vào bình chứa 2000ml dung dịch Ca(OH)2 0,015M.Kết thúc phản ứng thu được 2g kết tủa và dung dịch A.Lọc tách kết tủa rồi cho dung dịch Ba(OH)2 dư vào dung dịch A ta thu được p gam kết tủa.Cho toàn bộ lượng kim loại thi được ở trên vào bình chứa dung dịch HCl dư,phản ứng kết thúc ta thu được 0,672 lít khí H2 đktc.Viết các PTHH xảy ra.Tính C,m,p và xác định CT của oxit kim loại
khử 3,48 gam oxit một kim loại M cần dùng 1,344 lít H2(đktc). Toàn bộ lượng kim loại thu được cho tác dụng với dd HCl dư thu được 1,008 lít H2(đktc). Xác định M và oxit của nó.
Đặt a là hoá trị kim loại M cần tìm (a: nguyên, dương)
\(M_2O_a+aH_2\rightarrow\left(t^o\right)2M+aH_2O\left(1\right)\\ 2M+2aHCl\rightarrow2MCl_a+aH_2\left(2\right)\\Ta.có:n_{H_2\left(2\right)}=\dfrac{1,008}{22,4}=0,045\left(mol\right)\\ n_{H_2\left(1\right)}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\\ \Rightarrow n_{O\left(trong.oxit\right)}=n_{H_2O}=n_{H_2\left(1\right)}=0,06\left(mol\right)\\ \Rightarrow m_M=3,48-0,06.16=2,52\left(g\right)\\ n_{H_2\left(2\right)}=0,045\left(mol\right)\\ \Rightarrow n_{M\left(2\right)}=\dfrac{0,045.2}{a}=\dfrac{0,09}{a}\left(mol\right)\\ \Rightarrow M_M=\dfrac{2,52}{\dfrac{0,09}{a}}=28a\left(\dfrac{g}{mol}\right)\)
Xét các TH: a=1; a=2; a=3; a=8/3 thấy a=2 thoả mãn khi đó MM=56(g/mol), tức M là Sắt (Fe=56)
Đặt CTTQ của oxit sắt cần tìm là FemOn (m,n: nguyên, dương)
\(n_{Fe}=\dfrac{2,52}{56}=0,045\left(mol\right)\\n_O=0,06\left(mol\right)\)
=> m:n= 0,045:0,06=3:4
=>m=3;n=4
=> CTHH oxit: Fe3O4 (Sắt từ oxit)
Đúng 1
Bình luận (2)
Hoà tan hoàn toàn 4,69 gam hỗn hợp X gồm Fe và M bằng dung dịch HCl (dư), thu được 1,12 lít khí H2 (ở đktc). Dùng oxi dư để đốt cháy hoàn toàn với hỗn hợp X trên thu được 7,57 gam oxit. Xác định % khối lượng kim loại M là A. 35,82% B. 76,12% C. 64,18% D. 52,24%
Đọc tiếp
Hoà tan hoàn toàn 4,69 gam hỗn hợp X gồm Fe và M bằng dung dịch HCl (dư), thu được 1,12 lít khí H2 (ở đktc). Dùng oxi dư để đốt cháy hoàn toàn với hỗn hợp X trên thu được 7,57 gam oxit. Xác định % khối lượng kim loại M là
A. 35,82%
B. 76,12%
C. 64,18%
D. 52,24%
Hoà tan hoàn toàn 4,69 gam hỗn hợp X gồm Fe và M bằng dung dịch HCl (dư), thu được 1,12 lít khí H2 (ở đktc). Dùng oxi dư để đốt cháy hoàn toàn với hỗn hợp X trên thu được 7,57 gam oxit. Xác định % khối lượng kim loại M là A. 35,82% B. 76,12% C. 64,18% D. 52,24%
Đọc tiếp
Hoà tan hoàn toàn 4,69 gam hỗn hợp X gồm Fe và M bằng dung dịch HCl (dư), thu được 1,12 lít khí H2 (ở đktc). Dùng oxi dư để đốt cháy hoàn toàn với hỗn hợp X trên thu được 7,57 gam oxit. Xác định % khối lượng kim loại M là
A. 35,82%
B. 76,12%
C. 64,18%
D. 52,24%
Đáp án B
Chỉ xét kim loại trước H, nếu ko được, chọn Cu
Nhận xét: theo bảo toàn e: 2a + nb = 0,05.2 = 0,1
3a + mb = 0,045.4= 0,18 mol →như vậy m > 3 đoán ra Sn
56 a + 119 b = 4 , 69 a + b = 0 , 05 → a = 0 , 02 b = 0 , 03
%mM= 0,03.119/4,69 = 76,12%
Đúng 0
Bình luận (0)
Khử 3,48 gam một oxit của kim loại M cần dùng 1,344 lít
H
2
(đktc). Toàn bộ lượng kim loại M sinh ra cho tác dụng với dung dịch HCl dư thu được 1,008 lít H2 (đktc). Công thức oxit là A.
F
e
3
O
4
B.
F
e
2
O
3
C.
F
e
O
D.
Z...
Đọc tiếp
Khử 3,48 gam một oxit của kim loại M cần dùng 1,344 lít H 2 (đktc). Toàn bộ lượng kim loại M sinh ra cho tác dụng với dung dịch HCl dư thu được 1,008 lít H2 (đktc). Công thức oxit là
A. F e 3 O 4
B. F e 2 O 3
C. F e O
D. Z n O