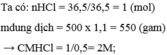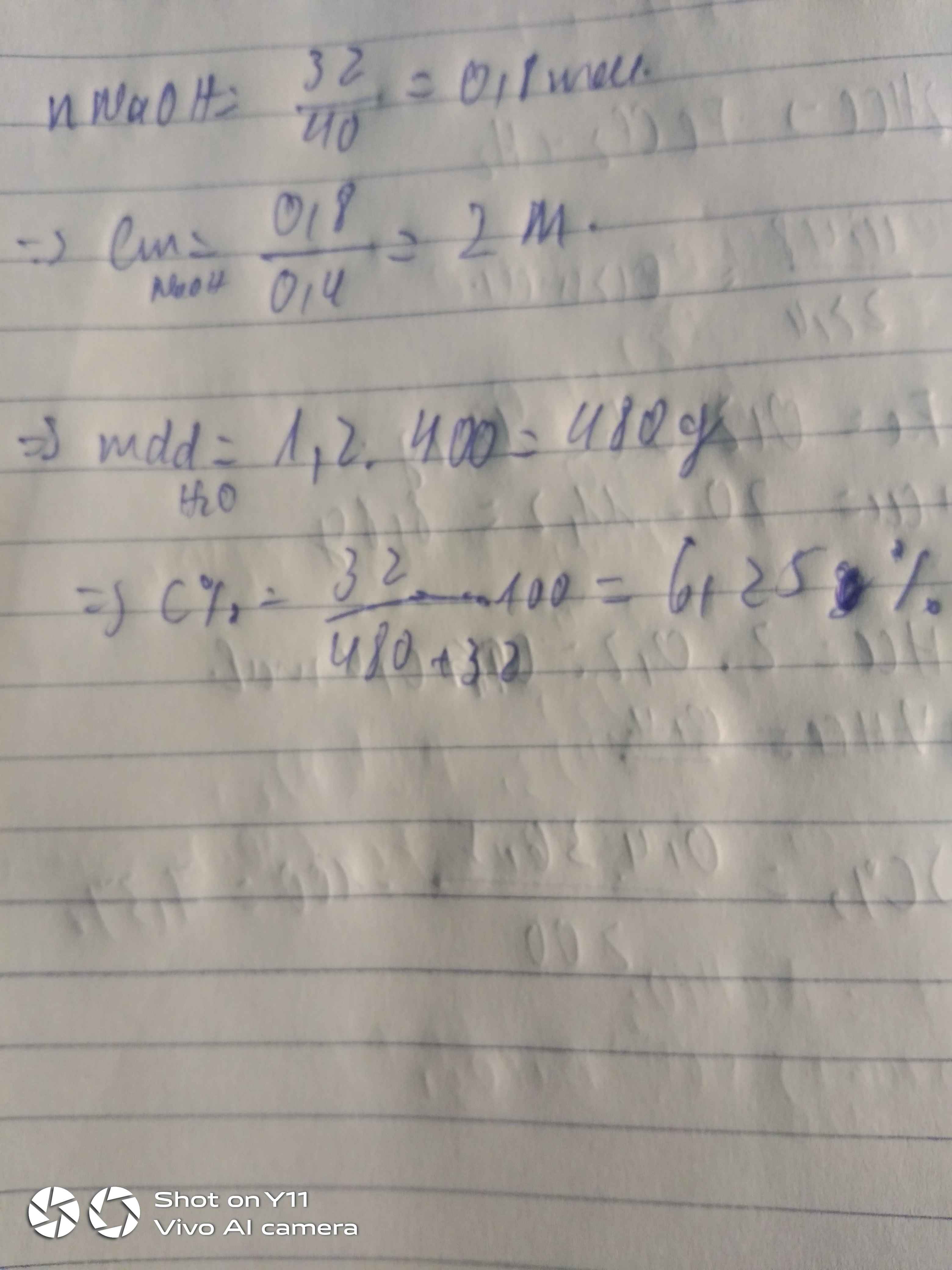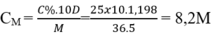Tính nồng độ phần trăm của dung dịch HCl 12M có khối lượng riêng D=1.19g/ml

Những câu hỏi liên quan
Dung dịch axit HCl trên thị trường bán có nồng độ cao nhất là 37%, khối lượng riêng D=1.19g/mol.
a) Tính nồng độ mol của dung dịch.
b) Tính nồng độ phần trăm của dd HCl 10.81 M có D=1.17g/l
Hòa tan 36,5 gam HCl vào nước, thu được 500ml dung dịch có khối lượng riêng D = 1,1 g/ml. Tính nồng độ mol và nồng độ phần trăm của dung dịch thu được.
Cho 32g NaOH vào nước được 400ml dd có khối lượng riêng D=1,2g/ml . Tính nồng độ mol và nồng độ phần trăm của dung dịch
Biết khối lượng CuSO4 là 3 gam khối lượng riêng của dung dịch D-1,15(g/ml),nồng độ phần trăm của dung dịch là 15%.Tính khối lượng của dung dịch? Thể tích dung dịch? Nồng dộ mol của dung dịch
Ta có: \(m_{ddCuSO_4}=\dfrac{3}{15\%}=20\left(g\right)\)
\(V_{ddCuSO_4}=\dfrac{20}{1,15}\approx17,39\left(ml\right)\)
Ta có: \(n_{CuSO_4}=\dfrac{3}{160}=0,01875\left(mol\right)\)
\(\Rightarrow C_{M_{CuSO_4}}=\dfrac{0,01875}{0,01739}\approx1,08M\)
Bạn tham khảo nhé!
Đúng 1
Bình luận (0)
Trộn 150ml dung dịch HCl 10% có khối lượng riêng D=1,206 g/ml với 250 ml dung dịch HCl 2M thu được dung dịch A . Tính nồng độ mol của dung dịch A
\(m_{dd_{HCl\left(10\%\right)}}=150\cdot1.206=180.9\left(g\right)\)
\(n_{HCl}=\dfrac{180.9\cdot10\%}{36.5}\approx0.5\left(mol\right)\)
\(n_{HCl\left(2M\right)}=0.25\cdot2=0.5\left(mol\right)\)
\(n_{HCl}=0.5+0.5=1\left(mol\right)\)
\(V_{dd_{HCl}}=150+250=400\left(ml\right)=0.4\left(l\right)\)
\(C_{M_{HCl}}=\dfrac{1}{0.4}=2.5\left(M\right)\)
Đúng 4
Bình luận (0)
Hòa tan 30 g NaCl vào 170 gam nước, được dung dịch có khối lượng riêng 1,1 gam/ml. Tính nồng độ phần trăm và nồng độ mol của dung dịch thu được
\(C\%=\dfrac{30}{170}.100\%=17,647\%\)
\(V_{\text{dd}}=\left(30+170\right)1,1=220ml\)
\(n_{NaCl}=\dfrac{30}{58,5}=0,513mol\)
\(C_M=\dfrac{0,513}{0,22}=0,696M\)
\(C\%_{NaCl}=\dfrac{30}{170+30}.100\%=15\%\\ C_M=C\%.\dfrac{10D}{M}=10.\dfrac{10.1,1}{58,5}=1,88M\)
Đúng 1
Bình luận (1)
Tính nồng độ phần trăm của HCl 10M bik khối lượng riêng của dd là D= 1,12g/ml
Coi $V_{dd} = 100(ml) $
Ta có :
$n_{HCl} = 0,1.10 = 1(mol)$
$m_{dd} = D.V = 1,12.100 = 112(gam)$
Suy ra :
$C\%_{HCl} = \dfrac{1.36,5}{112}.100\% = 32,59\%$
Đúng 3
Bình luận (0)
Tính nồng độ mol của dung dịch HCl, biết dung dịch HCl 25% có khối lượng riêng bằng 1,198 g/ml.
A. 8M
B. 8,2M
C. 7,9M
D. 6,5M
Hòa tan hoàn toàn 10.6g Na2CO3 vào nước được 200ml dung dịch Na2CO3 . Tính nồng độ phần trăm và nồng độ mol của dung dịch trên. Biết khối lượng riêng của dung dịch là 1.05g/ml
\(n_{Na_2CO_3}=\dfrac{10,6}{106}=0,1\left(mol\right)\\ \rightarrow C_{M\left(Na_2CO_3\right)}=\dfrac{0,1}{0,2}=0,5M\)
Ta có: \(C\%=\dfrac{C_M.M}{10.D}\)
\(\rightarrow C\%=\dfrac{0,5.106}{10.1,05}=5,05\%\)
Đúng 1
Bình luận (0)