dãy chuyển hóa oxitaxit-muối cacbonat tan--muối cacbonat ko tan - oxit bazo

Những câu hỏi liên quan
Mỗi tính chất hóa học dưới đây lấy hai ví dụ minh họa không nằm trong SGK
1.Muối cacbonat + dd Axit → Muối mới + CO2 + H2O
2.dd muối cacbonat + dd kiềm → Muối (= CO2)ko tan + Bazơ mới
3.Muối cacbonat axit + kiềm cùng kim loại → Muối trung hòa + H2O
4.Muối (_H2O) + Kiềm khác khim loại → 2 muối trung hòa + H2O
\(1.ZnCO_3+6HCl\rightarrow ZnCl_2+CO_2+H_2O\\ CuCO_3+H_2SO_4\rightarrow CuSO_4+CO_2+H_2O\\ 2.Li_2CO_3+Ca\left(OH\right)_2\rightarrow2LiOH+CaCO_3\\ Li_2CO_3+Ba\left(OH\right)_2\rightarrow2LiOH+BaCO_3\\ 3.KHCO_3+KOH\rightarrow K_2CO_3+H_2O\\ LiHCO_3+LiOH\rightarrow Li_2CO_3+H_2O\\ 4.2LiHCO_3+2KOH\rightarrow Li_2CO_3+K_2CO_3+2H_2O\\ 2KHCO_3+2LiOH\rightarrow Li_2CO_3+K_2CO_3+H_2O\)
Đúng 0
Bình luận (0)
Hòa tan 1 lượng muối cacbonat của kim loại hóa trị II trong 1 lượng vừa đủ dd H2SO4 20% thu đc 1 dd muối có nồng độ 28,196%. Tìm công thức hóa học của muối cacbonat trên
Đặt CT muối cacbonat: MCO3
Giả sử có 1 mol MCO3 phản ứng
MCO3 + H2SO4 ===> MSO4 + CO2 + H2O
1 1 1 1 1 ( mol)
<=>(M + 60) 98 (M + 96) 44 ( gam)
mdung dịch ( sau pứ)= M + 60 + 90 x 100 / 20 - 44 = ( M + 506 ) gam
Ta có: M + 96 = 0,28196 x ( M+506) => M = 65
=> M là Zn
Vậy công thức của muối cacbonat: ZnCO3
Đúng 0
Bình luận (1)
Hòa tan hoàn toàn 12,6 g một muối muối cacbonat của kim loại hóa trị II vào dung dịch H2SO4 loãng thu được 3,36 lít khí ở điều kiện tiêu chuẩn. Tìm CTHH của muối cacbonat
Hòa tan 5,8g muối cacbonat MCO3 bằng dung dịch H2SO4 loãng, vừa đủ thu được một chất khí và dung dịch G1. Cô cạn G1 được 7,6g muối sunfat trung hòa. Công thức hóa học của muối cacbonat là A. MgCO3 B. BaCO3 C. CaCO3 D. FeCO3
Đọc tiếp
Hòa tan 5,8g muối cacbonat MCO3 bằng dung dịch H2SO4 loãng, vừa đủ thu được một chất khí và dung dịch G1. Cô cạn G1 được 7,6g muối sunfat trung hòa. Công thức hóa học của muối cacbonat là
A. MgCO3
B. BaCO3
C. CaCO3
D. FeCO3
![]()
Sau phản ứng muối MCO3 chuyển thành MSO4
Cứ 1 mol MCO3 chuyển thành MSO4 khối lượng muối tăng lên một lượng là: 96 - 60 = 36 gam
Vậy nếu gọi số mol của MCO3 là x thì:
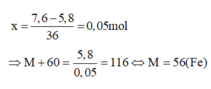
Đáp án D
Đúng 0
Bình luận (0)
Câu6:Tính chất hóa học chung của các kim loại là tác dụng là tác dụng với : A.Phi kim ,dd axit ,dd muối B. dd Bazo, dd axit, oxit axit C.Oxit bazo, dd axit D.dd axit ,dd muối ,kim loại Câu7:Dãy oxit nào tan đc trong nước để tạo thành dd bazo: A.K2O, BaO, CaO, Na2O B. K2O, BaO, CO, NO C.K2O, BaO, CuO, Na2O D.K2O, PbO, CaO, Na2O Câu8: Để phân biệt 3 kim loại Fe, Cu, Al người ta dùng : A.H2O và dd HCl B.Quỳ tím và dd NaOH ...
Đọc tiếp
Câu6:Tính chất hóa học chung của các kim loại là tác dụng là tác dụng với :
A.Phi kim ,dd axit ,dd muối B. dd Bazo, dd axit, oxit axit
C.Oxit bazo, dd axit D.dd axit ,dd muối ,kim loại
Câu7:Dãy oxit nào tan đc trong nước để tạo thành dd bazo:
A.K2O, BaO, CaO, Na2O B. K2O, BaO, CO, NO
C.K2O, BaO, CuO, Na2O D.K2O, PbO, CaO, Na2O
Câu8: Để phân biệt 3 kim loại Fe, Cu, Al người ta dùng :
A.H2O và dd HCl B.Quỳ tím và dd NaOH
C. dd H2SO4 và NaOH
Câu9: Có các kim loại sau :Fe, Zn, Ag, Al, Mg,Hg . Dãy kim loại tác dụng với dd Cu(NO3)2 là:
A.Fe, Zn, Ag, Al B. Zn, Al, Mg, Hg
C.Fe, Zn, Mg, Hg D.Tất cả đều sai
giải chi tiết giúp mk vớiiiiiii ạ
6: A
7: A
K2O + H2O --> 2KOH
BaO + H2O --> Ba(OH)2
CaO + H2O --> Ca(OH)2
Na2O + H2O --> 2NaOH
8: C
- Cho 3 chất rắn tác dụng với dd NaOH
+ Chất rắn tan, sủi bọt khí: Al
2Al + 2H2O + 2NaOH --> NaAlO2 + 3H2
+ Chất rắn không tan: Fe, Cu
- Cho 2 chất rắn còn lại tác dụng với dd H2SO4
+ Chất rắn tan, sủi bọt khí: Fe
Fe + H2SO4 --> FeSO4 + H2
+ Chất rắn không tan: Cu
9: D
Đúng 2
Bình luận (3)
Hòa tan hoàn toàn 23,8 gam hỗn hợp một muối cacbonat của các kim loại hóa trị I và muối cacbonat của kim loại hóa trị II trong dung dịch HCl. Sau phản ứng thu được 4,48 lít khí (đktc). Đem cô cạn dung dịch thu được thì khối lượng muối khan là: A. 13 g B. 15 g C. 26 g D. 30 g
Đọc tiếp
Hòa tan hoàn toàn 23,8 gam hỗn hợp một muối cacbonat của các kim loại hóa trị I và muối cacbonat của kim loại hóa trị II trong dung dịch HCl. Sau phản ứng thu được 4,48 lít khí (đktc). Đem cô cạn dung dịch thu được thì khối lượng muối khan là:
A. 13 g
B. 15 g
C. 26 g
D. 30 g
Đáp án C
Gọi công thức của hai muối trong hỗn hợp ban đầu là A2CO3 và BCO3.
Có các phản ứng:
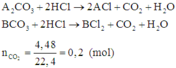
Quan sát phản ứng thấy khi cho hỗn hợp phản ứng với dung dịch HCl thì mỗi gốc C O 3 2 - trong muối được thay thế bởi hai gốc Cl-.
Có 1 mol C O 3 2 - bị thay thế bởi 2 mol Cl- thì khối lượng của muối tăng: (2.35,5 -60) = 11(gam)
Do đó khối lượng muối khan thu được khi cô cạn dung dịch là:
mmuối clorua = mmuối cacbonat + 0,2.11 = 23,8 + 0,2.11= 26 (gam)
Đúng 0
Bình luận (1)
Hoà tan hoàn toàn 1 lượng muối Cacbonat của 1 Kim loại hoá trị II bằng axit sunfuric 14,7%. Sau khi khí ko thoát ra nx, lọc bỏ lượng chất rắn ko tan thì thu đc dung dịch muối sunfat có nồng độ 17%. Tìm công thức của muối Cacbonat.
-Chọn số mol H2SO4 là 1,47 mol(để tính khối lượng liên quan đến 14,7% cho dễ tính)
RCO3+H2SO4\(\rightarrow\)RSO4+CO2+H2O
1,47\(\leftarrow\)1,47\(\rightarrow\).....1,47.....1,47
\(m_{dd_{H_2SO_4}}=\dfrac{1,47.98.100}{14,7}=980gam\)
\(m_{RCO_3}=1,47\left(R+60\right)gam\)
\(m_{RSO_4}=1,47\left(R+96\right)gam\)
\(m_{CO_2}=1,47.44=64,68gam\)
\(m_{dd}=1,47\left(R+60\right)+980-64,68=1,47R+1003,52\)
\(C\%RSO_4=\dfrac{1,47\left(R+96\right).100}{1,47R+1003,52}=17\)
\(\rightarrow\)147R+14112=24,99R+17059,84
\(\rightarrow\)122,01R=2947,84\(\rightarrow\)R\(\approx\)24(Mg)
\(\rightarrow\)MgCO3
Đúng 0
Bình luận (0)
Hòa tan vào nước 3,38 gam hỗn hợp muối cacbonat và muối hiđrocacbonat của một kim loại hóa trị I. Dung dịch thu được cho tác dụng với dung dịch HCl dư thấy có 0,672 lít khí (đktc) bay ra. Số mol muối cacbonat trong hỗn hợp trên là
A. 0,2.
B. 0,02.
C. 0,1.
D. 0,01.
Nhiệt phân muối cacbonat thu được 5.6gam canxioxit a.Viết phương trình hóa học b.Tính khối lượng muối canxi cacbonat thu được 8.4 gam canxi oxit
Muối cacbonat --phân huỷ--> CaO => muối đó là CaCO3
\(a,n_{CaO}=\dfrac{8,4}{56}=0,15\left(mol\right)\)
PTHH: \(CaCO_3\underrightarrow{t^o}CaO+CO_2\uparrow\)
0,15<----0,15
\(b,m_{CaCO_3}=0,15.100=15\left(g\right)\)
Đúng 0
Bình luận (2)


















