cho 6,72l hỗn hợp khí hidro vá oxi ở đktc có tỉ khối so với hidro=11. gây nổ hỗn hợp bằng tia lửa điện tính khối lượng nước tạo thành biết hiệu suất phản ứng là 90%

Những câu hỏi liên quan
cho 6,72l hỗn hợp khí hidro vá oxi ở đktc có tỉ khối so với hidro=11. gây nổ hỗn hợp bằng tia lửa điện tính khối lượng nước tạo thành biết hiệu suất phản ứng là 90%
TL:
2H2 + O2 ---> 2H2O
Số mol hh = 6,72/22,4 = 0,3 mol. Khối lượng trung bình hh = 2.11 = 22. Gọi x, y tương ứng là số mol của H2 và O2 trong hh. Ta có hệ:
x + y = 0,3 và 2x + 32y = 22.0,3 = 6,6. Giải hệ thu được x = 0,1; y = 0,2 mol.
Theo pt trên thì O2 dư nên số mol H2O được tính theo số mol H2. Vì hiệu suất là 90% nên số mol H2O = 0,9.0,1 = 0,09 mol. Do đó khối lượng nước = 18.0,09 = 1.62 g.
Đúng 0
Bình luận (0)
Cho 8.96l hỗn hợp khí H2 và O2 ở đktc có tỷ lệ thể tích 1:1. Gây nổ hỗn hợp bằng tia lửa điện thu đực hỗn hợp khí và hơi có tỉ khối so với H2 bằng 10. Tính hiệu suất phản ứng.
nhh = 8.96/22.4 = 0.4 (mol)
nH2 = nO2 = 0.4/2 = 0.2 (mol)
Đặt : nO2 (pư) = x (mol)
2H2 + O2 -to-> 2H2O
Bđ: 0.2____0.2
Pư: 2x_____x______2x
Kt : 0.2-2x__0.2-2x__2x
M = 10*2 = 20 (g/mol)
=> (0.2-2x)*2 + (0.2-2x)*32 + 2x * 18 = (0.2-2x+0.2-2x+2x)*20
=> x = 0.06
H% = 0.06*2/0.2 * 100% = 60%
Đúng 1
Bình luận (0)
\(n_{hh_1}=\dfrac{V_{hh_1}}{22,4}=0,4\left(mol\right)\)
\(\Rightarrow n_{H_2}=n_{O_2}=0,2\left(mol\right)\)
PTHH: \(2H_2+O_2\rightarrow2H_2O\)
.............2............1................2.........
Sản phẩm sau khi nổ gồm \(H_2O\left(n=2x\right);H_2\left(\text{dư};n=0,2-2x\right);O_2\left(\text{dư};n=0,2-x\right)\)
Mà hỗn hợp khí và hơi có tỉ khối so với H2 là 10 nên:
\(d_{\dfrac{hh_2}{H_2}}=\dfrac{M_{hh_2}}{2}=10\\ \Rightarrow M_{hh_2}=20\left(g/mol\right)\)
Ta có pt: \(18\cdot2x+2\left(0,2-2x\right)+32\left(0,2-x\right)=20\left(2x+0,2-2x+0,2-x\right)\)
Giải pt ta được \(x=0,06\)
\(H=\dfrac{2x}{0,2}\cdot100\%=\dfrac{2\cdot0,06}{0,2}\cdot100\%=60\%\)
Đúng 0
Bình luận (0)
cho 8,96l hỗn hợp khí h2 và o2(đktc) có tỉ lệ 1:1. gây nổ hỗn hợp bằng tia lửa điện thu đc hh khí và hơi nước có tỉ khối so vs h2 =10. tính hiệu suất phản ứng
dhh2H2=Mhh22=10⇒Mhh2=20(g/mol)dhh2H2=Mhh22=10⇒Mhh2=20(g/mol)
Ta có pt: 18⋅2x+2(0,2−2x)+32(0,2−x)=20(2x+0,2−2x+0,2−x)18⋅2x+2(0,2−2x)+32(0,2−x)=20(2x+0,2−2x+0,2−x)
Giải pt ta được x=0,06x=0,06
Đúng 0
Bình luận (4)
1. Đốt cháy hoàn toàn 1,1g hợp chất A thu được 2,2g cacbon dioxit và 0,9g nước. Xác định công thức hóa học của A. Biết 0,7 lít hơi của nó qui về đktc có khối lượng 2,75g2. Hỗn hợp X gồm H2, N2 có tỉ khối so với khí hidro bằng 3,6. Đun nóng hỗn hợp X với chất xúc tác thích hợp ( xảy ra phản ứng theo sơ đồ : N2 + H2 NH3 ), sau một thời gian thu được hỗn hợp Y có tỉ khối so với khí hidro bằng 4,5. Tính hiệu suất của phản ứng tổng hợp NH3. Biết các khí đo ở cùng điều kiện về nhiệt độ và áp suất.
Đọc tiếp
1. Đốt cháy hoàn toàn 1,1g hợp chất A thu được 2,2g cacbon dioxit và 0,9g nước. Xác định công thức hóa học của A. Biết 0,7 lít hơi của nó qui về đktc có khối lượng 2,75g
2. Hỗn hợp X gồm H2, N2 có tỉ khối so với khí hidro bằng 3,6. Đun nóng hỗn hợp X với chất xúc tác thích hợp ( xảy ra phản ứng theo sơ đồ : N2 + H2 = NH3 ), sau một thời gian thu được hỗn hợp Y có tỉ khối so với khí hidro bằng 4,5. Tính hiệu suất của phản ứng tổng hợp NH3. Biết các khí đo ở cùng điều kiện về nhiệt độ và áp suất.
Hỗn hợp khí X gồm hidro và một hidrocacbon. Nung nóng 24,64 lít hỗn hợp X (đktc), có Ni xúc tác, để phản ứng xảy ra hoàn toàn, biết rằng có hidrocacbon dư. Sau phản ứng thu được 20,4 gam hỗn hợp khí Y. Tỉ khối hỗn hợp so với hidro bằng 17. Khối lượng hidro có trong hỗn hợp X là? A. 3 g B. 2 g C. 1 g D. 0,5 g
Đọc tiếp
Hỗn hợp khí X gồm hidro và một hidrocacbon. Nung nóng 24,64 lít hỗn hợp X (đktc), có Ni xúc tác, để phản ứng xảy ra hoàn toàn, biết rằng có hidrocacbon dư. Sau phản ứng thu được 20,4 gam hỗn hợp khí Y. Tỉ khối hỗn hợp so với hidro bằng 17. Khối lượng hidro có trong hỗn hợp X là?
A. 3 g
B. 2 g
C. 1 g
D. 0,5 g
Đây là một ví dụ rất đơn giản nhưng đặc trưng về quan hệ số mol trong phản ứng cộng hidro của hidrocacbon chưa no
Dễ tính đươc
![]()
Trong phản ứng hidro hóa hidrocacbon chưa no thì số mol khí giảm chính bằng số mol hidro phản ứng suy ra ![]()
Mặt khác đề cho hidrocacbon dư, phản ứng hoàn toàn nên
![]()
suy ra ![]()
Đúng 0
Bình luận (0)
Đốt cháy hỗn hợp khí gồm 1,12 lít khí hidro và 1,68 lít khí oxi ở đktc. Tính khối lượng nước tạo thành sau phản ứng
2h2+o2→2h2o
nH2=1.12/22.4=0.05(mol)
nO2=1.68/22.4=0.075(mol)
ta có nH2/2=0.05/2=0.025<nO2/1=0.075
→H2 hết ,O2 dư.
theo pt nH2o=nH2=0.05(mol)
mH2o=0.05*18=0.9 (g)
xong![]()
Đúng 0
Bình luận (0)
Hỗn hợp khí gồm etan và propan có tỉ khối so với hidro là 20,25 được nung trong bình với chất xúc tác để thực hiện phản ứng đề hidro hóa. Sau một thời gian thu được hỗn hợp khí có tỉ khối so với hidro là 16,2 gồm có các ankan, anken và hidro. Tính hiệu suất phản ứng đề hidro biết rằng tốc độ phản ứng của etan và propan là như nhau? A. 30% B. 50% C. 25% D. 40%
Đọc tiếp
Hỗn hợp khí gồm etan và propan có tỉ khối so với hidro là 20,25 được nung trong bình với chất xúc tác để thực hiện phản ứng đề hidro hóa. Sau một thời gian thu được hỗn hợp khí có tỉ khối so với hidro là 16,2 gồm có các ankan, anken và hidro. Tính hiệu suất phản ứng đề hidro biết rằng tốc độ phản ứng của etan và propan là như nhau?
A. 30%
B. 50%
C. 25%
D. 40%
Đáp án C
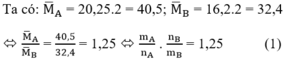
Áp dụng định luật bảo toàn khối lượng ta có: mA = mB
![]()
Giả sử ban đầu có 1 mol hỗn hợp A => nB = 1,25.1 = 1,25 mol
Trong phản ứng đề hidro hóa: số mol hỗn hợp khí sau phản ứng tăng, số mol tăng của hỗn hợp B so với hỗn hợp A chính là số mol các chất phản ứng.
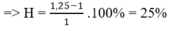
Đúng 0
Bình luận (0)
hỗn hợp X gồm Nitơ và Hidro có tỉ khối so với Hidro là 3,6. Nung nong X với xúc tác thích hợp, lúc đó xảy ra phản ứng. H2 + N2 -> NH3. Sau phản ứng thu được hỗn hợp khí Y có tỉ khối so với Hidro là 4,2826. Tính hiệu suất tổng hợp NH3
Coi n X = 1(mol)
Gọi n H2 = a(mol) ; n N2 = b(mol)
Ta có :
a + b = 1
2a + 28b = 3,6.2 = 7,2
=> a = 0,8 ; b = 0,2
3H2 + N2 \(\xrightarrow{t^o,xt}\)2 NH3
3a........a..............2a........(mol)
Vì n H2 / 3 > n N2 / 1 nên hiệu suất tinh theo số mol N2
Gọi hiệu suất là a => n N2 pư = a(mol)
m Y = m X = 7,2
=> n Y = 7,2/(4,2826.2) = 0,84(mol)
Sau phản ứng, Y gồm :
H2 : 0,8 - 3a
N2 : 0,2 - a
NH3 : 2a
=> n Y = 0,8 - 3a + 0,2 -a + 2a = 0,84
=> a = 0,08 = 8%
Đúng 3
Bình luận (0)
Hỗn hợp khí gồm etan và propan có tỉ khối so với hidro là 20,25 được nung trong bình với chất xúc tác để thực hiện phản ứng đề hidro hóa. Sau 1 thời gian thu được hỗn hợp khí có tỉ khối so với hidro là 16,2 gồm các ankan, anken và hidro. Tính hiệu suất phản ứng đề hidro hóa biết rằng tốc độ phản ứng của etan và propan là như nhau? A. 30% B. 50% C. 25% D. 40%
Đọc tiếp
Hỗn hợp khí gồm etan và propan có tỉ khối so với hidro là 20,25 được nung trong bình với chất xúc tác để thực hiện phản ứng đề hidro hóa. Sau 1 thời gian thu được hỗn hợp khí có tỉ khối so với hidro là 16,2 gồm các ankan, anken và hidro. Tính hiệu suất phản ứng đề hidro hóa biết rằng tốc độ phản ứng của etan và propan là như nhau?
A. 30%
B. 50%
C. 25%
D. 40%
Đáp án : C
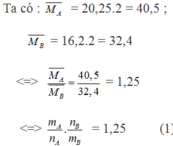
Áp dụng định luật bảo toàn khối lượng ta có: mA = mB
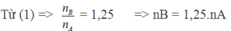
Giả sử ban đầu có 1 mol hỗn hợp A => nB = 1,25.1 = 1,25 mol
Trong phản ứng đề hidro hóa: số mol hỗn hợp sau phản ứng tăng, số mol tăng của hỗn hợp B so với hỗn hợp A chính là số mol các chất phản ứng
=> H = (1,25-1) .100% = 25%
Đúng 0
Bình luận (0)


















