Tính thể tích khí hidro và khí oxi (ở đktc) cần tác dụng với nhau để tạo ra được 1,8 g nước.

Những câu hỏi liên quan
Tính thể tích khí hidro và khí oxi (ở đktc) cần tác dụng với nhau để tạo ra 1,8 gam nước.
Câu hỏi : Cho 5,6 lít nước hidro tác dụng với 3,2g khíc Oxi tạo ra nướca) Viết phương trình hóa học b) Khí Oxi và khí hidro ,chất nào dư sau phân tử tính thể tích khí dư.Biết thể tích các khí đo ở đktc c) Tính Khối lượng nước thu được bằng 2 cách?d) Tính thể tích ko khí (đktc) cần dùng để đốt cháy hết lượng khí hidro trên biết thể tích oxi bằng 1/5 thể tích ko khí?
Đọc tiếp
Câu hỏi : Cho 5,6 lít nước hidro tác dụng với 3,2g khíc Oxi tạo ra nước
a) Viết phương trình hóa học
b) Khí Oxi và khí hidro ,chất nào dư sau phân tử tính thể tích khí dư.Biết thể tích các khí đo ở đktc
c) Tính Khối lượng nước thu được bằng 2 cách?
d) Tính thể tích ko khí (đktc) cần dùng để đốt cháy hết lượng khí hidro trên biết thể tích oxi bằng 1/5 thể tích ko khí>?
- Bạn ơi, 5,6 lít của nước hay hiđro
Đúng 1
Bình luận (1)
a) 2H2 +O2 -->2H2O
b) nH2=5,6/22,4=0,25(mol)
nO2=3,2/16=0,2(mol)
lập tỉ lệ :
\(\dfrac{0,25}{2}< \dfrac{0,2}{1}\)
=> H2 hết , O2 dư =>bài toán tính theo H2
theo PTHH : nO2=1/2nH2=0,125(mol)
nO2(dư)=0,2 -0,125=0,075(mol)
=>VO2(dư)=0,075.22,4=1,68(l)
c)
C1 : theo PTHH :nH2O=nH2=0,25(mol)
=>mH2O=0,25.18=4,5(g)
C2: mH2=0,25.2=0,5(g)
mO2(phản ứng)=0,125.32=4(g)
áp dụng định luật bảo toàn khối lượng ta có :
mH2O=4 +0,5=4,5(g)
d) Vo2(đktc)=0,125.22,4=2,8(l)
=> Vkk=2,8 : 1/5=14(l)
Đúng 0
Bình luận (0)
mik sửa lại:
nO2=3,2/32=0,1(mol)
lập tỉ lệ :
\(\dfrac{0,1}{1}< \dfrac{0,25}{2}\)
=>O2 hết ,H2 dư =>bài toán tính theo O2
theo PTHH :
nH2=2nO2=0,2(mol)
=>nH2(dư)=0,25 -0,2=0,05(mol)
=>VH2(dư)=0,05.22,4=1,12(l)
c) C1:
theo PTHH : nH2O=2nO2=0,2(mol)
=>mH2O=0,2.18=3,6(g)
C2: mH2=0,2.2=0,4(g)
áp dụng định luật bảo toàn khối lượng ta có :
mH2O=0,4 +3,2=3,6(g)
d) VO2=0,1.22,4=2,24(l)
=>Vkk=2,24 :1/5=11,2(l)
Đúng 0
Bình luận (0)
Tính thể tích khí hiđro (ở đktc) cần tác dụng với nhau để tạo ra đc 1,8 gam nước
\(n_{H_2o}=\dfrac{1,8}{18}=0,1\left(mol\right)\\
pthh:2H_2+O_2\underrightarrow{t^o}2H_2O\)
0,1 0,1
\(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
Đúng 4
Bình luận (0)
\(n_{H_2O}=\dfrac{1,8}{18}=0,1\left(mol\right)\)
PTHH: \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
0,1<--0,05<--0,1
\(\rightarrow\left\{{}\begin{matrix}V_{O_2}=0,05.22,4=1,12\left(l\right)\\V_{H_2}=0,1.22,4=2,24\left(l\right)\end{matrix}\right.\)
Đúng 3
Bình luận (0)
Tính thể tích khí hiđro và oxi(đktc) cần tác dụng với nhau để tạo ra được 1,8g nước.
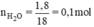
Phương trình phản ứng:
2H2 + O2 → 2H2O.
Đúng 0
Bình luận (0)
Tính thể tích khí hidro và oxi (dktc) cần tác dụng với nhau để tạo ra 7,2 gam nước
nH2O = 7,2/18 = 0,4 mol
2H2 + O2 ➝ 2H2O
0,4 0,2 0,4 (mol)
VH2 = 0,4.22,4 = 8,96 lít
VO2 = 0,2.22,4 = 4,48 lít
Đúng 2
Bình luận (0)
Tính thế tích khí hiđro và oxi ( ở đktc) cần tác dụng với nhau để tạo ra được 3,6 gam nước
\(PTHH:2H_2+O_2\rightarrow2H_2O\)
Số mol của 3,6 gam nc là:
\(n_{H_2O}=\dfrac{m}{M}=\dfrac{3,6}{18}=0,2\left(mol\right)\)
Thể tích khí Oxi là:
\(V_{O_2}=n.22,4=0,1.22,4=2,24\left(l\right)\)
Thể tích khí hidro là:
\(V_{H_2}=n.22,4=0,2.22,4=4,48\left(l\right)\)
Đúng 2
Bình luận (0)
\(n_{H_2O}=\dfrac{3,6}{18}=0,2\left(m\right)\)
\(PTHH:2H_2+O_2->2H_2O\)
tỉ lệ :2 1 2
số mol :0,2 0,1 0,2
\(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
\(V_{O_2}=0,1.22,4=2,24\left(l\right)\)
Đúng 1
Bình luận (0)
Cho 11,2g sắt tác dụng với dung dịch axit sunfuric loãng vừa đủ thu được sắt (ll) sunfat và khí hidro.
a) Tính thể tích khí hiđro sinh ra ở đktc .
b) Cần phải phân hủy bao nhiêu g thuốc tím để tạo đủ lượng oxi phản ứng với hết lượng khí hiđro sinh ra trong phản ứng trên ?
c) Nếu đốt cháy hoàn toàn bộ lượng sắt ở trên trong bình chứa 2,24 l khí oxi ở đktc thì sắt có cháy hết không ? Giải thích .
(Biết H1, O16, S32, Cu64, Fe56, K39, MN55)
Đọc tiếp
Cho 11,2g sắt tác dụng với dung dịch axit sunfuric loãng vừa đủ thu được sắt (ll) sunfat và khí hidro. a) Tính thể tích khí hiđro sinh ra ở đktc . b) Cần phải phân hủy bao nhiêu g thuốc tím để tạo đủ lượng oxi phản ứng với hết lượng khí hiđro sinh ra trong phản ứng trên ? c) Nếu đốt cháy hoàn toàn bộ lượng sắt ở trên trong bình chứa 2,24 l khí oxi ở đktc thì sắt có cháy hết không ? Giải thích . (Biết H=1, O=16, S=32, Cu=64, Fe=56, K=39, MN=55)
a)
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
0,2----------------------->0,2
=> VH2 = 0,2.22,4 = 4,48 (l)
b)
PTHH: 2H2 + O2 --to--> 2H2O
0,2-->0,1
PTHH: 2KMnO4 --to--> K2MnO4+ MnO2 + O2
0,2<------------------------------0,1
=> \(m_{KMnO_4}=0,2.158=31,6\left(g\right)\)
c) \(n_{O_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: 3Fe + 2O2 --to--> Fe3O4
Xét tỉ lệ: \(\dfrac{0,2}{3}>\dfrac{0,1}{2}\) => Fe dư
Đúng 1
Bình luận (0)
a.\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
0,2 0,2 ( mol )
\(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
b.\(2H_2+O_2\rightarrow\left(t^o\right)2H_2O\)
0,2 0,1 ( mol )
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\uparrow\)
0,2 0,1 ( mol )
\(m_{KMnO_4}=0,2.158=31,6\left(g\right)\)
c.\(n_{O_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
Xét: \(\dfrac{0,2}{3}\) > \(\dfrac{0,1}{2}\) ( mol )
--> Sắt không cháy hết
Đúng 0
Bình luận (0)
Tính thể tích khí Hiđro và khí Oxi (ở đktc) cần tác dụng với nhau để tạo ra 5,4g nước.
- giúp mình với cần gấp trong đêm nay !!!
Số mol nước tạo thành là:
nH2OnH2O = 1,8/18 = 0,1 (mol)
Phương trình phản ứng:
2H2 + O2 → 2H2O
2 mol 1 mol 2 mol
0,1 mol 0,05 mol 0,1 mol
Thể tích khí hidro tham gia phản ứng:
V = 22,4 x 0,1 = 2,24 (lít)
Thể tích khí oxi tham gia phản ứng:
V = 22,4 x 0,05 = 1,12 (lít)
- cái này là Hóa 8 mà sao cho dzô thể loại toán 7 vậy má =))
Tính thể tích khí hidro và khí oxi (ở đktc) cần tác dụng với nhau để tạo ra được 1,8 g nước.
Phương trình hóa học : 2H2 + O2 ---> 2H2O
Số mon nước tạo ra : 1,8/18 = 0,1 mol
Theo phương trình, để có 2 mol H2O cần 2 mol H2 và 1 mol O2
Vậy để có mol H2O ta cần 0,1 mol H2 và 0,05 mol O2
Thể tích ( đktc ) : 0,1 . 22,4 = 2,24 .
Thể tích O2 (đktc) : 0.05 . 22,4 = 1,12 l
Số mon nước tạo ra : 1,8/18 = 0,1 mol
Theo phương trình, để có 2 mol H2O cần 2 mol H2 và 1 mol O2
Vậy để có mol H2O ta cần 0,1 mol H2 và 0,05 mol O2
Thể tích ( đktc ) : 0,1 . 22,4 = 2,24 .
Thể tích O2 (đktc) : 0.05 . 22,4 = 1,12 l
Đúng 0
Bình luận (0)
PTPU
2H2+ O2---to---> 2H2O
0,1 0,05 <----- 0,1
ta có nH2O= 1,8/ 18= 0,1( mol)
=> VH2= 0,1x 22,4= 2,24( l)
VO2= 0,05x 22,4= 1,12( l)
Đúng 0
Bình luận (0)




























