1,Đót cháy 8,96 lít khí H2 trong bình đựng 6,72 lít khí O2. Tính khối lượng nước thư được ( ở đktc)
2, Hòa tan hết 12g bột kim loại M có hóa trị II ( ko đổi) trong nước thu được 3,36 lít khí H2 ( ở đktc). Xác định kim loại M
GIÚP MIK VS
Câu 8: Trộn 2,24 lít H2 và 4,48 lít khí O2 (đktc) rồi đốt cháy. Hỏi sau phản ứng khí nào dư, dư bao nhiêu lít? Tính khối lượng nước tạo thành?
Câu 9: Cho 19,2 gam kim loại R có hóa trị II tác dụng hết với khí oxi ở nhiệt độ cao. Sau phản ứng thu được 24 gam oxit.
a. Tính thể tích oxi ở điều kiện tiêu chuẩn tối thiểu phải dùng
b. Xác định công thức hóa học của kim loại R.
Câu 10: Có 200 gam dung dịch BaCl2 15%. Hỏi nồng độ dung dịch sẽ thay đổi như thế nào nếu:
a, Thêm vào dung dịch 100 gam nước
b, Cô đặc dung dịch đến khi dung dịch còn khối lượng 150 gam.
Câu 8:
Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PT: \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
Xét tỉ lệ: \(\dfrac{0,1}{2}< \dfrac{0,2}{1}\), ta được O2 dư.
Theo PT: \(\left\{{}\begin{matrix}n_{O_2\left(pư\right)}=\dfrac{1}{2}n_{H_2}=0,05\left(mol\right)\\n_{H_2O}=n_{H_2}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{O_2\left(dư\right)}=0,15\left(mol\right)\)
\(\Rightarrow V_{O_2\left(dư\right)}=0,15.22,4=3,36\left(l\right)\)
\(m_{H_2O}=0,1.18=1,8\left(g\right)\)
Bạn tham khảo nhé!
Câu 9:
a, PT: \(2R+O_2\underrightarrow{t^o}2RO\)
Theo ĐLBT KL, có: mR + mO2 = mRO
⇒ mO2 = 4,8 (g)
\(\Rightarrow n_{O_2}=\dfrac{4,8}{32}=0,15\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,15.22,4=3,36\left(l\right)\)
b, Theo PT: \(n_R=2n_{O_2}=0,3\left(mol\right)\)
\(\Rightarrow M_R=\dfrac{19,2}{0,3}=64\left(g/mol\right)\)
Vậy: M là đồng (Cu).
Câu 10:
Ta có: mBaCl2 = 200.15% = 30 (g)
a, m dd = 200 + 100 = 300 (g)
\(\Rightarrow C\%_{BaCl_2}=\dfrac{30}{300}.100\%=10\%\)
⇒ Nồng độ dung dịch giảm 5%
b, Ta có: \(C\%_{BaCl_2}=\dfrac{30}{150}.100\%=20\%\)
⇒ Nồng độ dung dịch tăng 5%.
Bạn tham khảo nhé!
Cho 7,5 gam hỗn hợp X gồm kim loại M (hóa trị không đổi) và Mg (tỉ lệ mol tương ứng 2 : 3) tác dụng với 3,36 lít Cl2, thu được hỗn hợp rắn Y. Hòa tan hết toàn bộ Y trong lượng dư dung dịch HCl, thu được 1,12 lít H2. Biết các phản ứng đều xảy ra hoàn toàn, các thể tích khí đều đo ở đktc. Kim loại M là
Cho 7,5 gam hỗn hợp X gồm kim loại M (hóa trị không đổi) và Mg (tỉ lệ mol tương ứng 2 : 3) tác dụng với 3,36 lít Cl2, thu được hỗn hợp rắn Y. Hòa tan hết toàn bộ Y trong lượng dư dung dịch HCl, thu được 1,12 lít H2. Biết các phản ứng đều xảy ra hoàn toàn, các thể tích khí đều đo ở đktc. Kim loại M là
Cho 7,5 gam hỗn hợp X gồm kim loại M (hóa trị không đổi) và Mg (tỉ lệ mol tương ứng 2 : 3) tác dụng với 3,36 lít Cl2, thu được hỗn hợp rắn Y. Hòa tan hết toàn bộ Y trong lượng dư dung dịch HCl, thu được 1,12 lít H2. Biết các phản ứng đều xảy ra hoàn toàn, các thể tích khí đều đo ở đktc. Kim loại M là
A. Al.
B. Na
C. Ca.
D. K.
Bài 24. Hòa tan 3,6g một kim loại A hóa trị II bằng một lượng dư axit HCl thu được 3,36 lít khí H2 (đktc). Xác định tên kim loại A
Bài 25. Hòa tan hoàn toàn 8,1g kim loại A hóa trị III trong dd HCl dư thu đucợ 10,08 lít khí H2 (đktc). Xác định tên A và m HCl đã dùng
Bài 24:
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ PTHH:A+2HCl\rightarrow ACl_2+H_2\uparrow\)
Theo pthh: nA = nH2 = 0,15 (mol)
=> MA = \(\dfrac{3,6}{0,15}=24\left(\dfrac{g}{mol}\right)\)
=> A là Mg
Bài 25:
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\\ PTHH:2A+6HCl\rightarrow2ACl_3+3H_2\uparrow\\ Mol:0,3\leftarrow0,9\leftarrow0,3\leftarrow0,45\\ \rightarrow\left\{{}\begin{matrix}M_A=\dfrac{8,1}{0,3}=27\left(\dfrac{g}{mol}\right)\Rightarrow A:Al\\m_{HCl}=0,9.36,5=32,85\left(g\right)\end{matrix}\right.\)
Bài 24.
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15mol\)
\(n_A=\dfrac{3,6}{M_A}\) mol
\(A+2HCl\rightarrow ACl_2+H_2\)
0,15 0,15 ( mol )
\(\Rightarrow\dfrac{3,6}{M_A}=0,15mol\)
\(\Leftrightarrow M_A=24\) ( g/mol )
=> A là Magie ( Mg )
Bài 25.
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45mol\)
\(n_A=\dfrac{8,1}{M_A}\) mol
\(2A+6HCl\rightarrow2ACl_3+3H_2\)
0,3 0,45 ( mol )
\(\Rightarrow\dfrac{8,1}{M_A}=0,3\)
\(\Leftrightarrow M_A=27\) g/mol
=> A là nhôm ( Al )
nH2 = 3.36/22.4 = 0.15 (mol)
M + H2SO4 => MSO4 + H2
0.15________________0.15
MM = 3.6/0.15 = 24
M là : Mg
Bảo toàn electron :
\(2n_M = 2n_{H_2}\\ \Rightarrow n_M = n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)\\ \Rightarrow M = \dfrac{3,6}{0,15} = 24(Magie)\)
Vậy Kim loại M là Magie
Bài 1: Đốt cháy toàn bộ 6,72 lít khí H2 trong không khí
a) Viết PTHH
b)Tính khối lượng và thể tích của O2
Bài 2: Tính số g nước thu được khi cho 8,4 lít H2 tác dụng với 2,8 lít O2 (cả 2 chất đều ở đktc)
Bài 1 :
a) \(2H_2 + O_2 \xrightarrow{t^o} 2H_2O\)
b)
\(n_{O_2} = \dfrac{1}{2}n_{H_2} = \dfrac{1}{2}. \dfrac{6,72}{22,4} = 0,15(mol)\\ \Rightarrow V_{O_2} = 0,15.22,4 = 3,36(lít)\\ \Rightarrow m_{O_2} = 0,15.32 = 4,8(gam)\)
Bài 2 :
\(2H_2 + O_2 \xrightarrow{t^o} 2H_2O\)
Vì :\( \dfrac{n_{H_2}}{2} = \dfrac{8,4}{22,4.2} = 0,1875 > \dfrac{n_{O_2}}{1} = \dfrac{2,8}{22,4} =0,125\) nên Hidro dư
\(n_{H_2O} = 2n_{O_2} = 0,125.2 = 0,25(mol)\\ \Rightarrow m_{H_2O} = 0,25.18 = 4,5(gam)\)
Bài 1. a) PTHH: 2\(H_2\) + \(O_2\) ---> 2\(H_2O\) (Lập và cân bằng phương trình)
0,3 mol 0,15 mol 0,3 mol
b) + Số mol của \(H_2\)
\(n_{H_2}\) = \(\dfrac{V}{22,4}\) = \(\dfrac{6,72}{22,4}\) = 0,3 (mol)
+ Khối lượng của \(O_2\)
\(m_{O_2}\) = n . M = 0,15 . 32 = 4,8 (g)
+ Thể tích của \(O_2\)
\(V_{O_2}\) = n . 22,4 = 0,15 . 22,4 = 3,36 (lít)
Bài 2. 2\(H_2\) + \(O_2\) ---> 2\(H_2O\) (Lập và cân bằng phương trình sau khi viết lại phương trình một lần nữa)
0,25 mol 0,125 mol 0,25 mol
+ Số mol của \(H_2\)
\(n_{H_2}\) = \(\dfrac{V}{22,4}\) = \(\dfrac{8,4}{22,4}\) = 0,375 (mol)
+ Số mol của \(O_2\)
\(n_{O_2}\) = \(\dfrac{V}{22,4}\) = \(\dfrac{2,8}{22,4}\) = 0,125 (mol)
+ Tỉ lệ: \(H_2\) \(O_2\)
\(\dfrac{0,375}{2}\) 0,125
0,1875 > 0,125
=> \(H_2\) dư; \(O_2\) hết
+ Số g của \(H_2O\) (nước):
\(m_{H_2O}\) = n . M = 0,25 . 18 = 4,5 (g)
_______________________________
Có gì không đúng nhắn mình nha :))
Hoà tan hết 12g một kim loại ( hoá trị II) bằng dung dịch H 2 S O 4 loãng thu được 6,72 lít khí H 2 (đktc). Kim loại này là
A. Zn
B. Fe
C. Ca
D. Mg
Hòa tan hoàn toàn hợp kim Al - Mg trong dung dịch HCl, thu được 8,96 lít khí H2 (đktc). Nếu cũng cho một lượng hợp kim như trên tác dụng với dung dịch NaOH dư, thu được 6,72 lít khí H2 (đktc). Thành phần phần trăm theo khối lượng của Al trong hợp kim là
A. 69,2%.
B. 65,4%.
C. 80,2%.
D. 75,4%.
Đáp án : A
+) HCl : Al -> 1,5H2
Mg -> H2
+) NaOH : Al -> 1,5H2
=> nAl = 2/3 nH2 = 0,2 mol
=> nMg = nH2(1) – nH2(Al) = 0,4 – 0,3 = 0,1 mol
=> %mAl = 69,23%
Hỗn hợp A chứa Fe và kim loại M có hóa trị không đổi trong mọi hợp chất. Tỉ lệ số mol của M và Fe trong hỗn hợp là 1 : 3. Cho 19,2 gam hỗn hợp A tan hết vào dung dịch HCl thu được 8,96 lít khí H2 Cho 19,2 gam hỗn hợp A tác dụng hết với Cl2 thì cần dùng 13,32 lít khí Cl2. Xác định kim loại M và phần trăm khối lượng các kim loại trong hỗn hợp A. Các thể tích khí đo ở đktc.
Gọi hóa trị của M là n
Gọi nMg = x mol ⇒ nFe = 3.x mol
Số mol H2 là: nH2 = 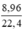 = 0,4 (mol)
= 0,4 (mol)
Số mol Cl2 là: nCl2 = 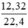 = 0,55 (mol)
= 0,55 (mol)
Các PTHH
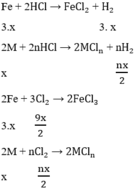
Theo bài ra ta có hệ phương trình:
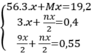
Giải hệ pt ⇒ x = 0,1 mol ⇒ n = 2 ⇒ M = 24
Vậy M là Mg
nMg = 0,1 mol ⇒ nFe = 0,3 mol
Thành phần % theo khối lượng
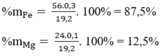
Hỗn hợp X gồm Fe và kim loại M hóa trị 3. Chia 38,6 gam X thành 2 phần bằng nhau. Phần 1 cho tan hoàn toàn trong dung dịch HNO3 loãng dư thu được 6,72 lít hỗn hợp khí Y gồm NO, N2O, d(Y/H2) = 17,8. Phần 2 cho vào dung dịch kiềm sau một thời gian thấy lượng H2 thoát ra vượt quá 6,72 lít. Tính % khối lượng kim loại M (khí đo ở đktc)
A. 58,03%
B. 41,97%
C. 56,12%
D. 43,08%