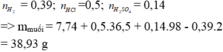Hoà tan 10,2g hh Mg & Al đem hoà tan trong H2SO4 loãng dư thì nhận được 11,2 lít H2.Tính khối lượng muối sunfat tạo thành

Những câu hỏi liên quan
Câu IV.1. Cho 5,6g hỗn hợp Mg, Zn, Al tác dụng với 100g dung dịch HCl 25,55% . Hỗn hợp kim loại có bị hoà tan hết không? Vì sao?2. Nung 10,2g hỗn hợp Al, Mg, Na trong khí Oxi dư. Sau phản ứng kết thúc thu được 17g hỗn hợp chất rắn . Mặt khác cho hỗn hợp các kim loại trên tác dụng với dung dịch HCl dư thì thấy thoát ra V lít khí và dung dịch A. Cô cạn A thì thu được mg muối Clorua khan. Tính V và m ?
Đọc tiếp
Câu IV.
1. Cho 5,6g hỗn hợp Mg, Zn, Al tác dụng với 100g dung dịch HCl 25,55% . Hỗn hợp kim loại có bị hoà tan hết không? Vì sao?
2. Nung 10,2g hỗn hợp Al, Mg, Na trong khí Oxi dư. Sau phản ứng kết thúc thu được 17g hỗn hợp chất rắn . Mặt khác cho hỗn hợp các kim loại trên tác dụng với dung dịch HCl dư thì thấy thoát ra V lít khí và dung dịch A. Cô cạn A thì thu được mg muối Clorua khan. Tính V và m ?
1)
mHCl = 25,55.100/100=25,55(g)
=> nHCl = 25,55/36,5=0,7(mol)
Pt: Mg + 2HCl --> MgCl2 + H2
Zn + 2HCl --> ZnCl2 + H2
2Al + 6HCl --> 2AlCl3 + 3H2
+Giả sử trong hh chỉ có Mg
nMg = 5,624=0,235,624=0,23 mol
Pt: Mg +......2HCl
0,23 mol-> 0,46 mol < 0,7 (mol)
=> HCl dư
<=> Hh Mg, Zn, Al bị hòa tan hết
Đúng 1
Bình luận (0)
Hòa tan hết 10,2g hh X gồm Al,Mg trong dd H2SO4 đặc nóng.Kết thúc phản ứng thu đc 4,48 lít (ddktc) hh 2 khí H2S và SO2 có tỉ lệ thể tích là 1:1.Phần trăm khối lượng của Al trong X là bao nhieu
- Ta có: số mol hh 2 khí là 0,2 mol và tỉ lệ thể tích là 1:1 nên số mol H2S =số mol SO2=0,1mol
- Gọi số mol Al là x và số mol Mg là y ta có 27x+24y=10,2
- Ta có: \(Al\rightarrow Al^{+3}+3e\)
\(Mg\rightarrow Mg^{+2}+2e\)
\(\rightarrow\)Tổng số mol e nhường=3x+2y
- Ngoài ra: \(S^{+6}+8e\rightarrow S^{-2}\)
\(S^{+6}+2e\rightarrow S^{+4}\)
\(\rightarrow\)Tổng số mol e nhận=8.0,1+2.0,1=1mol
- Vậy ta có: 3x+2y=1
- Giải hệ ta được x=y=0,2
\(\%m_{Al}=\dfrac{0,2.27.100}{10,2}\simeq52,94\%\)
Đúng 0
Bình luận (0)
Để hoà tan 3,51g hh A gồm Al và Mg cần dùng hết 50 ml dd hh H2SO4 2,4M và HCl 2,4M.Tính thành phần %các kim loại trong A
Hoà tan hết 7,74 gam hh bột Mg, Al bằng 500 ml dd hh HCl 1M và H2SO4 0,28M thu được dd X và 8,736 lít khí H2 (ở đktc). Cô cạn dd X thu được lượng muối khan là A. 38,93 gam. B. 103,85 gam. C. 25,95 gam. D. 77,86 gam.
Đọc tiếp
Hoà tan hết 7,74 gam hh bột Mg, Al bằng 500 ml dd hh HCl 1M và H2SO4 0,28M thu được dd X và 8,736 lít khí H2 (ở đktc). Cô cạn dd X thu được lượng muối khan là
A. 38,93 gam.
B. 103,85 gam.
C. 25,95 gam.
D. 77,86 gam.
Hoà tan 10,2g Al2O3 trong 350ml dd HCl 2M vừa đủ, tính khối lượng muối thu được
\(n_{Al_2O_3}=\dfrac{10.2}{102}=0.1\left(mol\right)\)
\(n_{HCl}=0.35\cdot2=0.7\left(mol\right)\)
\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
\(1.................6\)
\(0.1.............0.7\)
Lập tỉ lệ : \(\dfrac{0.1}{1}< \dfrac{0.7}{6}\Rightarrow HCldư\)
\(m_{AlCl_3}=0.1\cdot2\cdot133.5=26.7\left(g\right)\)
Đúng 1
Bình luận (0)
Đốt cháy x gam hh 3 kim loại Mg , Al , Fe bằng 0,8 mol O2 , thu được 37,4 gam hh rắn B và còn lại 0,2 mol O2 . Hoà tan 37,4 gam hh B bằng y lít dd H 2SO4 2 M ( vừa đủ ) , thu được z gam hh muối khan . Tính x, y,z .
40. Hoà tan 29,4 g hh Al, Cu, Mg vào dd HCl dư tạo 14 lít khí ở 00C, 0,8 atm. Phần không tan cho tác dụng với dd H2SO4 đđ tạo 6,72 lít khí SO2 ở đkc.a. Xác định % khối lượng mỗi kim loại trong hh.b. Cho ½ hh trên tác dụng với H2SO4 đđ khí tạo thành được dẫn qua dung dịch Ca(OH)2 sau 1 thời gian thu được 54 g kết tủa. Tính V dd Ca(OH)2 cần dùng.
Đọc tiếp
40. Hoà tan 29,4 g hh Al, Cu, Mg vào dd HCl dư tạo 14 lít khí ở 00C, 0,8 atm. Phần không tan cho tác dụng với dd H2SO4 đđ tạo 6,72 lít khí SO2 ở đkc.
a. Xác định % khối lượng mỗi kim loại trong hh.
b. Cho ½ hh trên tác dụng với H2SO4 đđ khí tạo thành được dẫn qua dung dịch Ca(OH)2 sau 1 thời gian thu được 54 g kết tủa. Tính V dd Ca(OH)2 cần dùng.
Hoà tan hết 59.6g hh gồm Al,Mg,Fe3O4 cần tới 500ml dd H2SO4 3M sau pư thu đc dd A và 16,8lit khí ở đk phòng. C% mỗi chất trong dd A
Cho 11,5 gam hh ( Na , Mg, Al ) hoà tan vào nước thu được 4,48 lit khí đo ở đktc , 6,15 gam chất rắn không tan và dd Y. lấy chất rắn không tan tavs dụng với dd HCl dư thu được 0.275 mol H2 . Tính % về khối lượng kim loại Na, Mg , Al trong 11,5 gam ban đầu
na+2h20->2naoh+h2
nh2=4.48/22.4=0.2mol
->nNa=0.2mol
bt e
2nMg+3nAl=2*0.275
bt kl
24nMg+27nAl=6.15
->nMg=0.2mol
nAl=0.05mol
->kl tung cai roi tinh phan tram
Đúng 0
Bình luận (1)