Hợp chất a tao thành từ 2 nguyên tố X;Y. Tổng số nguyên tử trong A=5 và tổng số hạt proton trong A=10. Biết rằng số electron của 1 nguyên tử X nhiều hơn số electron của 1 nguyên tử Y là 5. Tìm X;Y
Các bạn giúp mik với
a) Hợp chất tạo bởi nguyên tố Y ( hóa trị a) và nhóm NO3 có thành phần khối lượng là 34,043% Y. Xác định khối lượng mol của Y theo a?
b) R kết hợp với nguyên tố Oxi tao hợp chất X. Tính phần trăm khối lượng nguyên tố R trong X ?
Đ
ặ
t
:
Y
(
N
O
3
)
2
V
ì
:
%
m
Y
=
34
,
043
%
⇔
M
Y
M
Y
+
124
=
34
,
043
%
⇔
M
Y
=
64
(
g
m
o
l
)
⇒
Y
:
Đ
ồ
n
g
(
C
u
=
64
)
⇒
C
T
H
H
:
C
u
(
N
O
3
)
2
Thu gọn
Câu 39:Cho hợp chất có công thức CH3COONa hợp chất đó được tạo thành từ: A. 8 nguyên tố. B. 7 nguyên tố. C. 6 nguyên tố. D. 4 nguyên tố.
Trong bảng tuần hoàn các nguyên tố hóa học, nguyên tố X ở nhóm IIA, nguyên tố Y ở nhóm VA. Công thức của hợp chất tạo thành từ 2 nguyên tố trên có dạng là
A. X2Y3
B. X2Y5
C. X3Y2
D. X5Y2
Đáp án C
Do X dễ nhường 2 electron để đạt cấu hình bền vững => X có số oxi hóa +2
Y dễ nhận 3 electron để đạt cấu hình bền vững => Y có số oxi hóa -3
=> Công thức phù hợp là X3Y2
Trong bảng tuần hoàn các nguyên tố hóa học, nguyên tố X ở nhóm IA, nguyên tố Y ở nhóm VIA. Công thức của hợp chất tạo thành từ 2 nguyên tố trên có dạng là
A. X2Y3
B. X2Y
C. XY
D. X5Y2
Đáp án B
Do X dễ nhường 1 electron để đạt cấu hình bền vững → X có số oxi hóa +1
Y dễ nhận 2 electron để đạt cấu hình bền vững → Y có số oxi hóa -2
→ Công thức phù hợp là X2Y
Trong bảng tuần hoàn các nguyên tố hoá học, nguyên tố X ở nhóm IIA, nguyên tố Y ở nhóm VA. Công thức của hợp chất tạo thành từ 2 nguyên tố trên có dạng là.
A. X3Y2
B. X2Y3
C. X2Y5
D. X5Y2
Đáp án A
Ví dụ : Mg (IIA) và P(VA) chỉ tạo được hợp chất Mg3P2
nguyên tố x có trong hợp chất x(OH)2 biết nguyên tố x chiếm 54,054% xác định nguyên tố x và viết công thức phân tử hợp chất (tính thành phần, phần trăm về khối lượng của mỗi nguyên tố trong hợp chất)
Trong các chất sau, chất nào là đơn chất, chất nào là hợp chất?
a) Đường ăn
b) Nước
c) Khí hydrogen (được tạo thàn từ nguyên tố H)
d) Vitamin C (được tạo thành từ các nguyên tố C, H và O)
e) Lưu huỳnh (được tạo thành từ nguyên tố S)
Hợp chất: `a, b, d`
Đơn chất: `c, e`
Cho 2 nguyên tố X và Y thuộc hai chu kì liên tiếp ( Z X < Z Y ) và cùng số thứ tự của nhóm trong bảng tuần hoàn (nhóm A và nhóm B).
- Nguyên tố X tạo thành hợp chất ion với clo ứng với công thức XC1.
- Nguyên tố Y cũng tạo thành hợp chất với clo hợp chất YC1 trong đó khối lượng của clo chiếm 24,7%.
Xác định các nguyên tố X và Y.
X tạo bởi chất ion với clo có công thức là XC1, vậy X là kim loại có hoá trị I.
Y cùng số nhóm với X vậy cũng có hoá trị I, công thức clorua của nó là YC1.
Ta có:
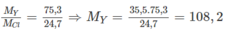
( M Y và M Cl lần lượt là NTK của nguyên tố Y và nguyên tố clo). Đó là Ag. Nguyên tố X cùng chu kì, cùng số thứ tự nhóm với Ag là kali (K))
Nguyên tố A có hóa trị III, nguyên tố B có hóa trị II. Hãy tính tỉ lệ nguyên tử của A và B trong hợp chất tạo thành từ 2 nguyên tố đó.
Một hợp chất có phân tử gồm 2 nguyên tử nguyên tố X liên kết với 3 nguyên tử O và nặng hơn phân tử hidro 76 lần. a. Tính phân tử khối hợp chất. b. Tìm nguyên tố X và viết CTHH của hợp chất. c. Tính thành phần phần trăm theo khối lượng của X trong hợp chất. Biết: O =16, H = 1, Al =27, Cr = 52, Cu =64
a)Gọi hợp chất cần tìm là \(X_2O_3\)
Theo bài ta có: \(PTK_{X_2O_3}=76M_{H_2}=76\cdot2=152\left(đvC\right)\)
b)Mà \(2M_X+3M_O=152\Rightarrow M_X=\dfrac{152-3\cdot16}{2}=52\left(đvC\right)\)
X là nguyên tố Crom(Cr).
Vậy CTHH là \(Cr_2O_3\).
c)\(\%X=\dfrac{2\cdot52}{2\cdot52+3\cdot16}\cdot100\%=68,42\%\)