Đốt cháy hỗn hợp 14g hỗn hợp Mg, Na cần dùng 4,48l O2 (ĐKTC)
a) PTHH
b) Tính mMg, mNa
Đốt cháy hỗn hợp 14g hỗn hợp Mg, Na cần dùng 4,48l O2 (ĐKTC)
a) PTHH
b) Tính mMg, m Na
Đốt cháy hoàn toàn hỗn hợp A gồm CH4, C2H4, C2H2 thu được 17,9g lít khí CO2 (đktc) và 18g H2O.
a) Viết các PTHH. b) Tính thể tích khí O2 (đktc) cần dùng và khối lượng hỗn hợp A.a, \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
\(C_2H_4+3O_2\underrightarrow{t^o}2CO_2+2H_2O\)
\(2C_2H_2+5O_2\underrightarrow{t^o}4CO_2+2H_2O\)
b, Sửa đề: 17,9 (l) → 17,92 (l)
Ta có: \(n_{CO_2}=\dfrac{17,92}{22,4}=0,8\left(mol\right)=n_C\)
\(n_{H_2O}=\dfrac{18}{18}=1\left(mol\right)\Rightarrow n_H=1.2=2\left(mol\right)\)
⇒ mA = mC + mH = 0,8.12 + 2.1 = 11,6 (g)
Theo ĐLBT KL, có: mA + mO2 = mCO2 + mH2O
⇒ mO2 = 0,8.44 + 18 - 11,6 = 41,6 (g)
\(\Rightarrow n_{O_2}=\dfrac{41,6}{32}=1,3\left(mol\right)\Rightarrow V_{O_2}=1,3.22,4=29,12\left(l\right)\)
Đốt cháy hoàn toàn 6,3g hỗn hợp A gồm Mg và kim loại R (có hóa trị không đổi) trong bình chứa 3,36 ℓ khí O2 ở đktc thu được hỗn hợp B chứa 2 oxit.
a. Xác định kim loại R? Biết trong hỗn hợp mR : mMg = 3:4.
b. Tính ![]() để hòa tan hoàn toàn hỗn hợp B?
để hòa tan hoàn toàn hỗn hợp B?
Ta có hệ: \(\left\{{}\begin{matrix}m_R+m_{Mg}=6,3\\\dfrac{m_R}{m_{Mg}}=\dfrac{3}{4}\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}m_R=2,7g\\m_{Mg}=3,6g\end{matrix}\right.\)
\(n_{Mg}=\dfrac{3,6}{24}=0,15mol\)
\(2Mg+O_2\underrightarrow{t^o}2MgO\)
0,15 0,075
Mà \(\Sigma n_{O_2}=\dfrac{3,36}{22,4}=0,15mol\)
\(\Rightarrow n_{O_2\left(R\right)}=0,15-0,075=0,075mol\)
\(4R+nO_2\underrightarrow{t^o}2R_2O_n\)
\(\dfrac{2,7}{R}\) 0,075
\(\Rightarrow\dfrac{2,7}{R}\cdot n=4\cdot0,075\Rightarrow9n=A\)
Nhận thấy n=3 thỏa mãn\(\Rightarrow R=27\Rightarrow Al\)
Câu b khuất đề nên mình ko làm đc nhé!!!
Đốt cháy hoàn toàn 1 hỗn hợp khí gồm CO và H2 cần dùng 6,72L O2 . Khí sinh ra có 4,48L khí CO2 . Biết các khí ở ĐKTC . Tính thành phần trăm theo thể tích của các khí trong hỗn hợp
nO2(tổng)=0,3(mol); nCO2=0,2(mol)
CO + 1/2 O2 -to-> CO2 (1)
0,2<----0,1<-------0,2(mol)
H2 + 1/2 O2 -to-> H2O (2)
0,4<---0,2<-------0,4(mol)
nO2(2)= nO2(tổng)- nO2(1)=0,3-0,1=0,2(mol)
Vì số mol tỉ lệ thuận thể tích:
=> %V(CO/hh)= [0,2/(0.2+0,4)].100=33,333%
=>%V(H2/hh)=100%-33,333%=66,667%
Để đốt cháy hết 6,84 gam hỗn hợp Al và Mg cần dùng V lít O2 (đktc) thu được 12,12 gam hỗn hợp 2 oxit kim loại
a) Tính V
b) Tính % khối lượng mỗi kim loại trong hỗn hợp ban đầu
Hòa tan hoàn toàn 12,8g hỗn hợp gồm Mg,MgO bằng dd HCl 14,6% vừa đủ.Sau phản ứng thấy thoát ra 4,48l khí A(ở đktc) a, Viết PTHH b,Tính khối lượng mỗi chất trong hỗn hợp c,Tính khối lượng dd HCl cần dùng
a)
$Mg + 2HCl \to MgCl_2 + H_2$
$MgO + 2HCl \to MgCl_2 + H_2o$
b)
Theo PTHH : $n_{Mg} = n_{H_2} = \dfrac{4,48}{22,4} = 0,2(mol)$
$m_{Mg} = 0,2.24 = 4,8(gam)$
$m_{MgO} = m_{hh} - m_{Mg} = 12,8 - 4,8 = 8(gam)$
c)
$n_{MgO} = \dfrac{8}{40} = 0,2(mol)$
$n_{HCl} = 2n_{Mg} + 2n_{MgO} = 0,8(mol)$
$m_{dd\ HCl} = \dfrac{0,8.36,5}{14,6\%} = 200(gam)$
2. Để đốt cháy hết 13,2 gam hỗn hợp gồm bột Fe và Mg cần dùng hết 4,48 lít khí
O2 (đktc) tạo ra sản phẩm là Fe3O4 và MgO theo phản ứng:
Fe + O2 ⎯⎯to→ Fe3O4; Mg + O2 ⎯⎯to→ MgO Tính khối lượng mỗi chất có
trong hỗn hợp ban đầu?
Gọi x, y lần lượt là số mol của Fe và Mg.
Theo đề, ta có: \(56x+24y=13,2\) (*)
Ta có: \(n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH:
\(3Fe+2O_2\overset{t^o}{--->}Fe_3O_4\left(1\right)\)
\(2Mg+O_2\overset{t^o}{--->}2MgO\left(2\right)\)
Theo PT(1): \(n_{O_2}=\dfrac{2}{3}.n_{Fe}=\dfrac{2}{3}x\left(mol\right)\)
Theo PT(2): \(n_{O_2}=\dfrac{1}{2}.n_{Mg}=\dfrac{1}{2}y\left(mol\right)\)
\(\Rightarrow\dfrac{2}{3}x+\dfrac{1}{2}y=0,2\) (**)
Từ (*) và (**), ta có HPT:
\(\left\{{}\begin{matrix}56x+24y=13,2\\\dfrac{2}{3}x+\dfrac{1}{2}y=0,2\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,15\\y=0,2\end{matrix}\right.\)
\(\Rightarrow m_{Fe}=0,15.56=8,4\left(g\right)\)
\(m_{Mg}=0,2.24=4,8\left(g\right)\)
Đốt cháy một hỗn hợp gồm bột Fe và Mg, trong đó Mg có khối lượng 0,48g cần dùng 672ml O 2 (ở đktc). Hãy tính khối lượng kim loại Fe.
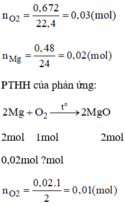
n O 2 còn lại tác dụng Fe là: 0,03 – 0,01 = 0,02 mol
a)
$4P + 5O_2 \xrightarrow{t^o} 2P_2O_5$
$S + O_2 \xrightarrow{t^o} SO_2$
b) Gọi $n_P = a(mol) ; n_S = b(mol) \Rightarrow 31a + 32b = 15,6(1)$
Theo PTHH :
$n_{O_2} = \dfrac{5}{4}n_P + n_S = \dfrac{5a}{4} + b = \dfrac{13,44}{22,4} = 0,6(2)$
Từ (1)(2) suy ra : a = 0,4 ; b = 0,1
$m_P = 0,4.31 = 12,4(gam)$
$m_S = 0,1.32 = 3,2(gam)$
c) $n_{P_2O_5} = \dfrac{1}{2}n_P = 0,2(mol) \Rightarrow m_{P_2O_5} = 0,2.142 = 28,4(gam)$
$n_{SO_2} = n_S = 0,1(mol) \Rightarrow V_{SO_2} = 0,1.22,4 = 2,24(lít)$