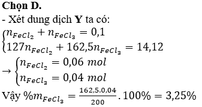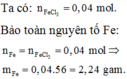Đốt cháy hoàn toàn 2,8g sắt trong khí clo thu được FeCl3

Những câu hỏi liên quan
Đốt cháy hoàn toàn 6,72 g sắt trong bình đựng 3,36 lít khí clo (đktc) sinh ra sắt (III) clorua FeCl3 . Tính khối lượng các chất thu được sau phản ứng
\(n_{Fe}=\dfrac{6.72}{56}=0.12\left(mol\right)\)
\(n_{Cl_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(2Fe+3Cl_2\underrightarrow{^{t^0}}2FeCl_3\)
\(0.1........0.15....0.1\)
\(m_{Fe\left(dư\right)}=\left(0.12-0.1\right)\cdot56=1.12\left(g\right)\)
\(m_{FeCl_3}=0.1\cdot162.5=16.25\left(g\right)\)
Đúng 0
Bình luận (1)
Đốt cháy sắt trong khí clo, người ta thu được 32,5 gam muối
F
e
C
l
3
. Thể tích khí clo (đktc) đã tham gia phản ứng là A. 6,72 lít. B. 13,44 lít. C. 4,48 lít. D. 2,24 lít.
Đọc tiếp
Đốt cháy sắt trong khí clo, người ta thu được 32,5 gam muối F e C l 3 . Thể tích khí clo (đktc) đã tham gia phản ứng là
A. 6,72 lít.
B. 13,44 lít.
C. 4,48 lít.
D. 2,24 lít.
Chọn đáp án A
n F e C l 3 = 32 , 5 162 , 5 = 0 , 2 m o l
Bảo toàn nguyên tố Cl
2 n C l 2 = 3 n F e C l 3 ⇒ n C l 2 = 0 , 3 m o l ⇒ V = 0 , 3.22 , 4 = 6 , 72 l
Đúng 0
Bình luận (0)
Đốt cháy 5,6 gam bột Fe trong khí clo thu được 14,12 gam rắn X. Hòa tan hết X trong lượng dư nước cất thu được 200 gam dung dịch Y. Các phản ứng xảy ra hoàn toàn. Nồng độ FeCl3 có trong dung dịch Y là A. 5,20%. B. 6,50%. C. 7,80%. D. 3,25%.
Đọc tiếp
Đốt cháy 5,6 gam bột Fe trong khí clo thu được 14,12 gam rắn X. Hòa tan hết X trong lượng dư nước cất thu được 200 gam dung dịch Y. Các phản ứng xảy ra hoàn toàn. Nồng độ FeCl3 có trong dung dịch Y là
A. 5,20%.
B. 6,50%.
C. 7,80%.
D. 3,25%.
đốt cháy hoàn toàn m gam Fe cần 3,36 lít khí Clo (đktc) và thu được FeCl3 theo phương trình: Fe + Cl2 -> FeCl3
a. Hãy cân bằng phương trình phản ứng trên
b. Tính m
nCl2= 3,36/22,4=0,15(mol)
a) PTHH: 2 Fe + 3 Cl2 -to->2 FeCl3
b) nFe= 2/3. nCl2 = 2/3. 0,15=0,1(mol)
=>mFe=0,1.56=5,6(g)
=>m=5,6(g)
Đúng 2
Bình luận (0)
Số mol của khí clo ở dktc
nCl2= \(\dfrac{V_{Cl}}{22,4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
a) Pt : 2Fe + 3Cl2 → 2FeCl3\(|\)
2 3 2
0,1 0,15
b) Số mol của sắt
nFe = \(\dfrac{0,05.3}{2}=0,1\left(mol\right)\)
Khối lượng của sắt
mFe = nFe . MFe
= 0,1 . 56
= 5,6 (g)
Chúc bạn học tốt
Đúng 2
Bình luận (1)
đốt cháy hoàn toàn lượng sắt trong khí clo dư.Hòa tan sản phẩm pứ vào nước thu đc ddX.Thêm dd NaOH vào ddX.Hiện tượng quan sát là gì
Sắt cháy trong clo: clo mất màu vàng lục, sắt từ màu xám chuyển dần sang màu nâu đen, chất này tan trong nước tạo thành ddX là FeCl3, khi thêm dd NaOH vào thì có xuất hiện kết tủa màu nâu đỏ là Fe(OH)3
\(2Fe+3Cl_2\underrightarrow{t^o}2FeCl_3\\ FeCl_3+3NaOH\rightarrow Fe\left(OH\right)_3\downarrow+3NaCl\)
Đúng 2
Bình luận (0)
Người ta đốt cháy hoàn toàn 2,8g sắt thu được oxit sắt từ Fe3O4
Hãy:
a, lập phương trình hóa học của phản ứng
b, Tính khối lượng sản phẩm thu được sau phản ứng
c, tính thể tích không khí cần dùng cho phản ứng trên biết oxi chiếm khoảng 1/5 của kk và các khí được đo ở đktc
có nFe =2,8/56 = 0,05 mol
a. PTHH : 3Fe + 2O2 --to--> Fe3O4
b. Theo phương trình , nO2 = 2/3 . nFe = 0,05.2/3 = 1/30 mol
⇒ VO2 = 1/30 .22,4 =0,7467 lít
c. có nFe3O4 = nFe/3 = 0,05/3 = 1/60 mol
⇒ mFe3O4 = 1/60 .232 =3,867 gam
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn m gam Fe trong khí Cl2 dư, thu được 6,5 gam FeCl3. Giá trị của m là:
A. 2,24.
B. 2,80.
C. 1,12.
D. 0,56.
Đốt cháy hoàn toàn m gam Fe trong khí Cl2 dư, thu được 6,5 gam FeCl3. Giá trị của m là: A. 2,24. B. 2,80. C. 1,12. D. 0,56.
Đọc tiếp
Đốt cháy hoàn toàn m gam Fe trong khí Cl2 dư, thu được 6,5 gam FeCl3. Giá trị của m là:
A. 2,24.
B. 2,80.
C. 1,12.
D. 0,56.
Đốt cháy hoàn toàn m gam Fe trong khí Cl2 dư, thu được 6,5 gam FeCl3. Giá trị của m là ?
A. 2,80.
B. 2,24.
C. 0,56.
D. 1,12.
Đáp án : B
Bảo toàn Fe :
n F e = n F e C l 3 = 0,04 mol
=> m = 2,24g
Đúng 0
Bình luận (0)