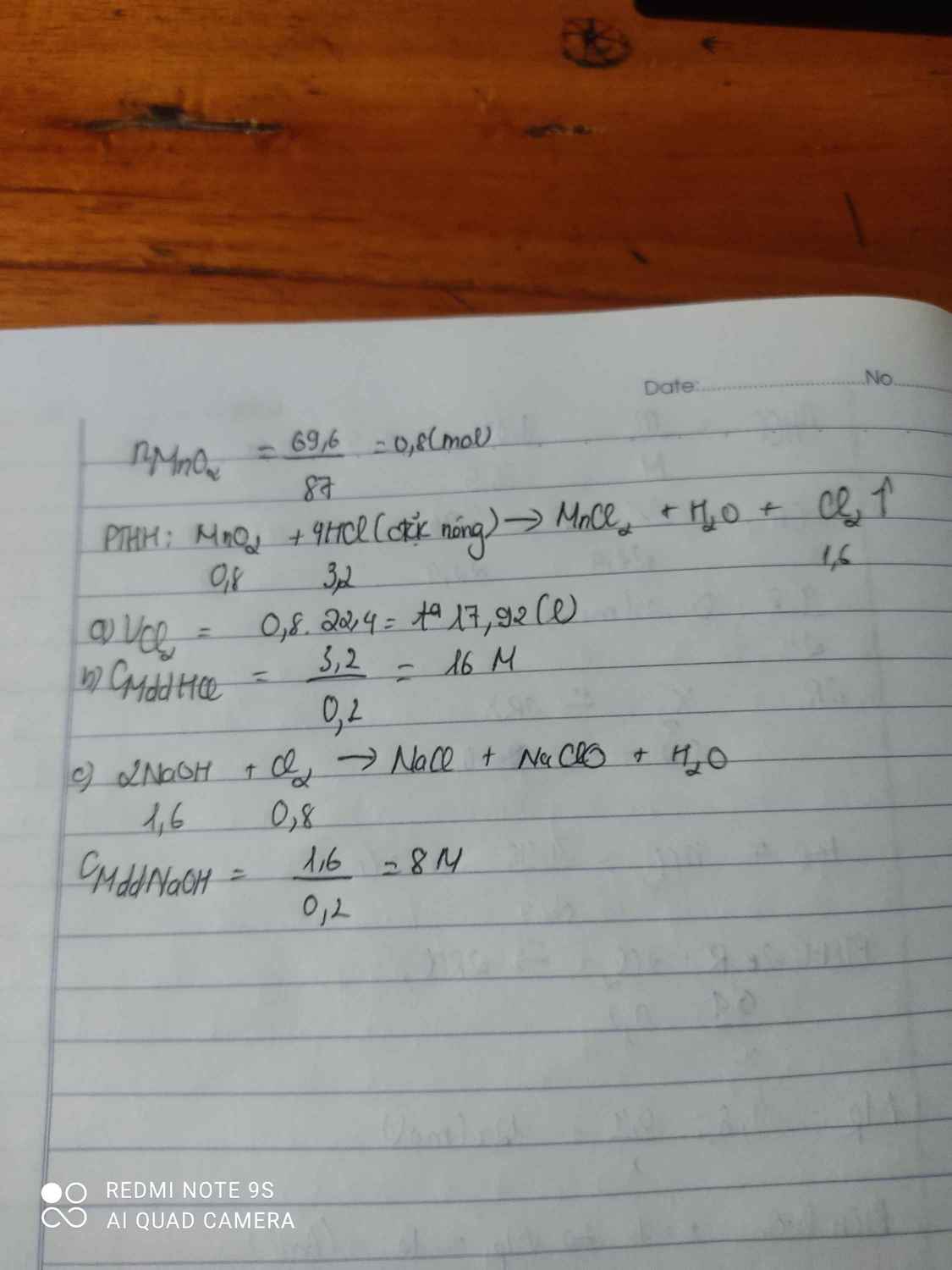Tính thể tích khí H2 ở điều kiện tiêu chuẩn khi cho 4,8 gam Mg tác dụng với 500ml dung dịch HCl 1M

Những câu hỏi liên quan
Câu 1: Cho 4,8 gam kim loại Mg ở dạng bột tác dụng với oxi thu được hỗn hợp chất rắn Y . Hòa tan hoàn toàn Y trong H2SO4 1M thu được 3,36 lít khí H2 (điều kiện tiêu chuẩn). Tính thể tích dung dịch H2SO4 đã phản ứng ?Câu 2: Cho 0,015 mol một loại hợp chất oleum vào nước thu được 200 ml dung dịch X. Để trung hoà 100 ml dung dịch X cần dùng 200 ml dung dịch NaOH 0,15M. Xác định công thức của oleum.
Đọc tiếp
Câu 1: Cho 4,8 gam kim loại Mg ở dạng bột tác dụng với oxi thu được hỗn hợp chất rắn Y . Hòa tan hoàn toàn Y trong H2SO4 1M thu được 3,36 lít khí H2 (điều kiện tiêu chuẩn). Tính thể tích dung dịch H2SO4 đã phản ứng ?
Câu 2: Cho 0,015 mol một loại hợp chất oleum vào nước thu được 200 ml dung dịch X. Để trung hoà 100 ml dung dịch X cần dùng 200 ml dung dịch NaOH 0,15M. Xác định công thức của oleum.
Câu 1 :
n Mg = 4,8/24 =0,2(mol)
n H2 = 3,36/22,4 = 0,15(mol)
Y gồm 0,2 mol Mg và O
Bảo toàn electron :
2n Mg = 2n O + 2n H2
<=> n O = 0,2 - 0,15 = 0,05(mol)
\(2H^+ + O^{2-} \to H_2O\\ 2H^+ + 2e \to H_2\)
Ta có :
n H+ = 2n O + 2n H2 = 0,15.2 + 0,05.2 = 0,4(mol)
=> n H2SO4 = 1/2 nH+ = 0,2(mol)
=> V dd H2SO4 = 0,2/1 = 0,2(lít)
Đúng 1
Bình luận (0)
Câu 2 :
Oleum : H2SO4.nSO3
n NaOH = 0,2.0,15 = 0,03(mol)
2NaOH + H2SO4 $\to$ Na2SO4 + 2H2O
n H2SO4 = 1/2 n NaOH = 0,015(mol)
=> trong 200 ml dung dịch X chứa 0,015.2 = 0,03(mol) H2SO4
H2SO4.nSO3 + nH2O $\to$ (n + 1)H2SO4
Theo PTHH :
\(n_{oleum} = \dfrac{n_{H_2SO_4}}{n + 1}\\ \Rightarrow 0,015 = \dfrac{0,03}{n + 1}\\ \Rightarrow n = 1\)
Vậy oleum cần tìm là H2SO4.SO3
Đúng 1
Bình luận (0)
Câu 3 (1 điểm). Cho 4,8 gam Mg tác dụng hoàn toàn với dung dịch HCl, sau phản ứng thu được m gam MgCl2 và khí H2 ở điều kiện tiêu chuẩn.
a.Viết phương trình phản ứng xảy ra.
b.Tính thể tích khí tạo thành (tính theo trên trường).
c.Tính m=?.
\(a.Mg+2HCl\rightarrow MgCl_2+H_2\\ b.n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\\ n_{H_2}=n_{Mg}=0,2\left(mol\right)\\ V_{H_2}=0,2.22,4=4,48\left(l\right)\\ c.n_{MgCl_2}=n_{Mg}=0,2\left(mol\right)\\ m_{MgCl_2}=0,2.95=19\left(g\right)\)
Đúng 3
Bình luận (0)
cho 5,6g Fe tác dụng với 500ml dung dịch HCL 1m ----------> thu được Fecl2 và khí H2
a) chất nào còn dư số lượng dư là bao nhiêu
b) tính khối lượng muối FeCl2 thu được
c) tính thể tích H2 ở ĐKTC ( điều kiện tiêu chuẩn )
d) tính nồng đồ % của 200g dung dịch HCL
a, Ta có: \(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
\(n_{HCl}=0,5.1=0,5\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,5}{2}\), ta được HCl dư.
Theo PT: \(n_{HCl\left(pư\right)}=2n_{Fe}=0,2\left(mol\right)\Rightarrow n_{HCl\left(dư\right)}=0,5-0,2=0,3\left(mol\right)\)
\(\Rightarrow m_{HCl\left(dư\right)}=0,3.36,5=10,95\left(g\right)\)
b, \(n_{FeCl_2}=n_{Fe}=0,1\left(mol\right)\Rightarrow m_{FeCl_2}=0,1.127=12,7\left(g\right)\)
c, \(n_{H_2}=n_{Fe}=0,1\left(mol\right)\Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)
d, \(m_{HCl}=0,5.36,5=18,25\left(g\right)\Rightarrow C\%_{HCl}=\dfrac{18,25}{200}.100\%=9,125\%\)
Đúng 6
Bình luận (0)
\(a.n_{Fe}=\dfrac{5,6}{56}=0,1mol\\ n_{HCl}=0,5.1=0,5mol\\ Fe+2HCl\rightarrow FeCl_2+H_2\\ \Rightarrow\dfrac{0,1}{1}< \dfrac{0,5}{2}\Rightarrow HCl.dư\\ n_{HCl}=2n_{Fe}=0,2mol\\ m_{HCl\left(dư\right)}=\left(0,5-0,2\right).36,5=10,95\%\\ b)n_{Fe}=n_{FeCl_2}=n_{H_2}=0,1mol\\ m_{FeCl_2}=0,1.12,7g\\ c)V_{H_2}=0,1.22,4=2,24l\\ d)C_{\%HCl}=\dfrac{0,2.36,5}{200}\cdot100=3,65\%\)
Đúng 1
Bình luận (0)
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
\(n_{HCl}=0,5.1=0,5\left(mol\right)\)
PTHH :
\(Fr+2HCl\rightarrow FeCl_2+H_2\uparrow\)
0,1 0,2 0,1 0,1
\(\dfrac{0,1}{1}< \dfrac{0,5}{2}\)
--> Tính theo Fe
HCl dư
\(a,m_{HCldư}=\left[0,5.\left(0,1.2\right)\right].36,5=10,95\left(g\right)\)
\(b,m_{FeCl_2}=0,1.127=12,7\left(g\right)\)
\(c,V_{H_2}=0,1.22,4=2,24\left(l\right)\)
\(d,m_{HCl}=0,5.36,5=18,25\left(g\right)\)
\(C\%_{HCl}=\dfrac{18,25}{200}.100\%=9,125\%\)
Đúng 1
Bình luận (0)
Cho 4,8 gam Mg tác dụng vừa đủ với dung dịch HCl, sau phản ứng thu được sản phẩm
gồm MgCl2 và V lít khí H2. Biết thể tích khí đo ở điều kiện chuẩn 25oC, 1bar. Giá trị của V là ? (Mg: 24; Cl: 35,5; H: 1). Biết PTHH là: Mg + 2HCl→MgCl2+ H2
\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
PTHH: Mg + 2HCl --> MgCl2 + H2
_____0,2------------------------>0,2
=> VH2 = 0,2.24,79 = 4,958 (l)
Đúng 1
Bình luận (1)
Cho 10,8 gam nhôm tác dụng hết với 200 gam dung dịch HCl Hãy cho biết thể tích khí H2 sinh ra ở điều kiện tiêu chuẩn Tính khối lượng muối tạo thành tính nồng độ phần trăm của dung dịch HCl tham gia phản ứng
\(n_{Al} = \dfrac{10,8}{27} = 0,4(mol)\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\\ n_{AlCl_3} = n_{Al} = 0,4(mol)\\ m_{AlCl_3} = 0,4.133,5 = 53,4(gam)\\ n_{HCl} =3 n_{Al} = 1,2(mol)\\ C\%_{HCl}= \dfrac{1,2.36,5}{200}.100\% = 21,9\%\)
Đúng 1
Bình luận (0)
1:cho 13g Zn tác dụng vừa đủ với dung dịch H2SO4 1M.
a,tính thể tích khí H thu được ở đktc
b,tính thể tích dung dịch HCL
2:cho Mg tác dụng vừa đủ với 200ml dung dịch HCL 2M
a,tính khối lượng Mg đã dùng
b,tính thể tích H thu được ở điều kiện tiêu chuẩn
1:
a) \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PTHH: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow\)
______0,2------>0,2------------------->0,2_____(mol)
=> \(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
b) \(V_{ddH_2SO_4}=\dfrac{0,2}{1}=0,2\left(l\right)\)
2:
a)
\(n_{HCl}=2.0,2=0,4\left(mol\right)\)
PTHH: \(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
______0,2<------0,4------------------>0,2______(mol)
=> \(m_{Mg}=0,2.24=4,8\left(g\right)\)
b) \(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
Đúng 1
Bình luận (1)
cho 4 gam muối CaCO3 tác dụng với 14,6 g dung dịch HCl 25%
a, tính thể tích khí h2 thu được ở điều kiện tiêu chuẩn
b khối lượng các chất còn lại sau phản ứng
Xem chi tiết
Đề bài phải là thể tích CO2 bạn nhé!
a, PT: \(CaCO_3+2HCl\rightarrow CaCl_2+H_2O+CO_2\)
Ta có: \(n_{CaCO_3}=\dfrac{4}{100}=0,04\left(mol\right)\)
\(m_{HCl}=\dfrac{14,6.25}{100}=3,65\left(g\right)\Rightarrow n_{HCl}=\dfrac{3,65}{36,5}=0,1\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,04}{1}< \dfrac{0,1}{2}\), ta được HCl dư.
Theo PT: \(n_{CO_2}=n_{CaCO_3}=0,04\left(mol\right)\)
\(\Rightarrow V_{CO_2}=0,04.22,4=0,896\left(l\right)\)
b, Theo PT: \(\left\{{}\begin{matrix}n_{HCl\left(pư\right)}=2n_{CaCO_3}=0,08\left(mol\right)\\n_{CaCl_2}=n_{CaCO_3}=0,04\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{HCl\left(dư\right)}=0,02\left(mol\right)\Rightarrow m_{HCl\left(dư\right)}=0,02.36,5=0,73\left(g\right)\)
\(m_{CaCl_2}=0,04.111=4,44\left(g\right)\)
Bạn tham khảo nhé!
Đúng 1
Bình luận (0)
PTHH: \(CaCO_3+2HCl\rightarrow CaCl_2+H_2O+CO_2\uparrow\)
Ta có: \(\left\{{}\begin{matrix}n_{CaCO_3}=\dfrac{4}{100}=0,04\left(mol\right)\\n_{HCl}=\dfrac{14,6\cdot25\%}{36,5}=0,1\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,04}{1}< \dfrac{0,1}{2}\) \(\Rightarrow\) HCl còn dư, CaCO3 p/ứ hết
\(\Rightarrow\left\{{}\begin{matrix}n_{CO_2}=n_{CaCl_2}=0,04\left(mol\right)\\n_{HCl\left(dư\right)}=0,02\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{CO_2}=0,04\cdot22,4=0,896\left(l\right)\\m_{CaCl_2}=0,04\cdot111=4,44\left(g\right)\\m_{HCl\left(dư\right)}=0,02\cdot36,5=0,73\left(g\right)\end{matrix}\right.\)
Đúng 1
Bình luận (0)
Cho 2,4g mg tác dụng vừa đủ với 200g dung dịch HCl. Hãy tính: a) thể tích H2 thoát ra ở điều kiện tiêu chuẩn? b) nồng độ % của dung dịch axit HCl đã dùng? ( cho biết: O= 16; H= 1; Mg= 24; Cl= 35,5 )
PTHH: \(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
Ta có: \(n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{HCl}=0,2\left(mol\right)\\n_{H_2}=0,1\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}C\%_{HCl}=\dfrac{0,2\cdot36,5}{200}\cdot100\%=3,65\%\\V_{H_2}=0,1\cdot22,4=2,24\left(l\right)\end{matrix}\right.\)
Đúng 1
Bình luận (0)
Cho 69,6 gam MnO2 tác dụng với dung dịch HCl đặc dư. Biết phản ứng xảy ra hoàn toàna. Tính thể tích khí H2 thu được ở điều kiện tiêu chuẩn?b. Tính nồng độ mol dung dịch axit cần dùng cho phản ứng. Biết thể tích dung dịch axit ban đầu là 200ml.c. Dẫn toàn bộ lượng khí clo thu được ở trên cho tác dụng hết với 200ml dung dịch NaOH để điều chế nước Javen. Viết PTHH và tính nồng độ mol của dung dịch NaOH cần dùng.
Đọc tiếp
Cho 69,6 gam MnO2 tác dụng với dung dịch HCl đặc dư. Biết phản ứng xảy ra hoàn toàn
a. Tính thể tích khí H2 thu được ở điều kiện tiêu chuẩn?
b. Tính nồng độ mol dung dịch axit cần dùng cho phản ứng. Biết thể tích dung dịch axit ban đầu là 200ml.
c. Dẫn toàn bộ lượng khí clo thu được ở trên cho tác dụng hết với 200ml dung dịch NaOH để điều chế nước Javen. Viết PTHH và tính nồng độ mol của dung dịch NaOH cần dùng.