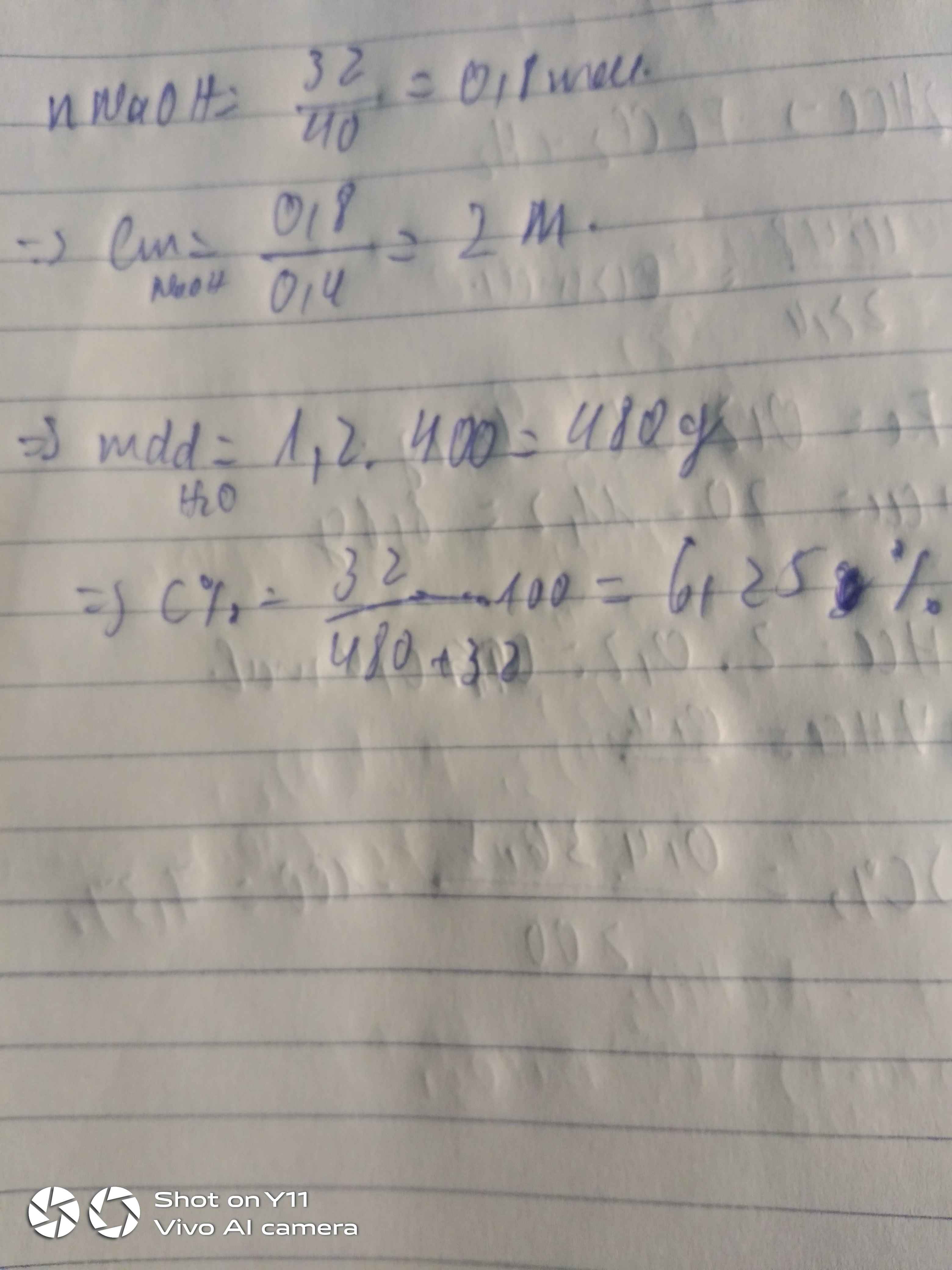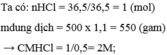Tính nồng độ phần trăm của HCl 10M bik khối lượng riêng của dd là D= 1,12g/ml

Những câu hỏi liên quan
1. Trộn 400ml dd KOH 1,5M với 600ml dd KOH 1,2M. Tính nồng độ mol và nồng động phần trăm của của dd sau khi trộn dung dịch sau trộn có khối lượng riêng bằng 1,12g/ml?2.a/ Trộn lẫn 100 gam dd H2SO4 10% với 200 gam dd H2SO4 C% thu được dd H2SO4 30%. Tính C%b/ Trong Cho m gam NaCl vào nước được 200 gam dung dịch NaCl 15%. Tính nồng độ mol của dung dich NaCl. Biết dung dich NaCl có D 1,1g/ml
Đọc tiếp
1. Trộn 400ml dd KOH 1,5M với 600ml dd KOH 1,2M. Tính nồng độ mol và nồng động phần trăm của của dd sau khi trộn dung dịch sau trộn có khối lượng riêng bằng 1,12g/ml?
2.
a/ Trộn lẫn 100 gam dd H2SO4 10% với 200 gam dd H2SO4 C% thu được dd H2SO4 30%. Tính C%
b/ Trong Cho m gam NaCl vào nước được 200 gam dung dịch NaCl 15%. Tính nồng độ mol của dung dich NaCl. Biết dung dich NaCl có D= 1,1g/ml
2
b
mNaCl=\(\dfrac{200.15}{100}\)=30(g)
nNaCl=\(\dfrac{30}{58,5}\)=0.51(mol)
VddNaCl=\(\dfrac{200}{1,1}\)=181.8(ml)=0.1818(l)
CMNaCl=\(\dfrac{0,51}{0,1818}\)=2.8(M)
Đúng 1
Bình luận (0)
Cho 32g NaOH vào nước được 400ml dd có khối lượng riêng D=1,2g/ml . Tính nồng độ mol và nồng độ phần trăm của dung dịch
Hòa tan 7,8 g nhôm và magie vào dd axitsunfuric 2M có khối lượng riêng 1,12g/ml lấy vừa đủ, sau phản ứng thu được 8,96 dm3 khí hiđro (ĐKTC)
a) Tính thành phần khối lượng hỗn hợp kim loại
b) Tính khối lượng dd axit đã dùng
c) Tính nồng độ M của dd sau phản ứng cho thể tích dd thay đổi không đáng kể
a) \(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\left(1dm^3=1l\right)\)
PTHH: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Mol: x 1,5x
PTHH: Mg + H2SO4 → MgSO4 + H2
Mol: y y
Ta có: \(\left\{{}\begin{matrix}27x+24y=7,8\\1,5x+y=0,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
\(\%m_{Al}=\dfrac{0,2.27.100\%}{7,8}=69,23\%;\%m_{Mg}=100-69,23=30,77\%\)
b)
PTHH: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Mol: 0,2 0,3 0,1
PTHH: Mg + H2SO4 → MgSO4 + H2
Mol: 0,1 0,1 0,1
\(V_{ddH_2SO_4}=\dfrac{0,3+0,1}{2}=0,2\left(l\right)=200\left(ml\right)\)
\(\Rightarrow m_{ddH_2SO_4}=1,12.200=224\left(g\right)\)
c) \(C_{M_{ddAl_2\left(SO_4\right)_3}}=\dfrac{0,1}{0,2}=0,5M\)
\(C_{M_{ddMgSO_4}}=\dfrac{0,1}{0,2}=0,5M\)
Đúng 0
Bình luận (0)
Dung dịch axit HCl trên thị trường bán có nồng độ cao nhất là 37%, khối lượng riêng D=1.19g/mol.
a) Tính nồng độ mol của dung dịch.
b) Tính nồng độ phần trăm của dd HCl 10.81 M có D=1.17g/l
Hòa tan hoàn toàn 16g hỗn hợp 2 axit cho và ngo vào 500ml dd axit HCl nồng độ M thì PƯ vừa đủ a, viết PTHH b, Tính thành phần % về khối lượng của mỗi axit trong hỗn hợp ban đầu c, Biết khối lượng riêng của dd HCl ban đầu là 1,15g ml. Tính nồng độ % của dd axit HCl đã dùng
Tính Thể tích của dd HCl 3,65%, có khối lượng riêng là 1.05 g/ml cần dùng để trung hòa hết 400 ml dd Ba(OH)2 nồng độ 17,1% có khối lượng riêng 1,20g/ml
\(2HCl+Ba\left(OH\right)_2\rightarrow BaCl_2+2H_2O\)
Theo PT : \(n_{HCl}=2n_{Ba\left(OH\right)_2}=2.\dfrac{400.1,2.17,1\%}{171}=0,96\left(mol\right)\)
=> \(V_{HCl}=\dfrac{0,96.36,5}{3,65\%.1,05}=914,29\left(ml\right)\)
Đúng 5
Bình luận (0)
\(m_{Ba\left(OH\right)_2}=400\cdot1.2\cdot17.1\%=82.08\left(g\right)\)
\(n_{Ba\left(OH\right)_2}=\dfrac{82.08}{171}=0.48\left(mol\right)\)
\(Ba\left(OH\right)_2+2HCl\rightarrow BaCl_2+2H_2O\)
\(0.48..............0.96\)
\(m_{HCl}=0.96\cdot36.5=35.04\left(g\right)\)
\(m_{dd_{HCl}}=\dfrac{35.04}{3.65\%}=960\left(g\right)\)
\(V_{dd_{HCl}}=\dfrac{960}{1.05}=1008\left(ml\right)\)
Đúng 3
Bình luận (1)
hòa tan 11g một hỗn hợp gồm sắt và nhôm bằng dd HCl vừa đủ, sau pư thu được 8,96l khí H2 ở đktc.
a/ tính thành phần phần trăm khối lượng các kim loại có trong hỗn hợp.
b/ Tính thể tích HCl đã dùng (dd HCl 2M).
c/ tính nồng độ phần trăm của dd sau phản ứng biết khối lượng riêng của dd HCl 2M là 1,12g/ml.
Gọi số mol của Fe và Al trong hỗn hợp lần lượt là x và y \(\left(x,y\in N\text{*}\right)\)
Số mol H2 thu được là: \(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
PTHH:
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\left(1\right)\\ 2Al+3HCl\rightarrow2AlCl_3+3H_2\left(2\right)\)
Theo PTHH (1): \(n_{Fe}=x\Rightarrow n_{H_2}=x\)
Theo PTHH (2): \(n_{Al}=y\Rightarrow n_{H_2}=\dfrac{3}{2}y\)
Từ các PTHH và đề bài ta có:
\(\left(I\right)\left\{{}\begin{matrix}x+\dfrac{3}{2}y=0,4\\56x+27y=11\end{matrix}\right.\)
Giải hệ phương trình I ta được x = 0,1 ; y = 0,2
Khối lượng của Fe và Al trong hỗn hợp là:
\(m_{Fe}=0,1.56=5,6\left(g\right)\\ m_{Al}=0,2.27=5,4\left(g\right)\)
Thành phần phần trăm khối lượng Fe và Al trong hỗn hợp là:
\(\%m_{Fe}=\dfrac{5,6}{11}\cdot100\approx50,91\%\\ \%m_{Al}=100\%-50,91\%=49,09\%\)
b) Từ PTHH (1) ta có: \(n_{HCl\left(1\right)}=2x=0,2\left(mol\right)\)
Từ PTHH (2) ta có: \(n_{HCl\left(2\right)}=3y=0,6\left(mol\right)\)
Tổng số mol HCl tham gia phản ứng với hỗn hợp là:
\(n_{HCl}=0,2+0,6=0,8\left(mol\right)\)
Thể tích dung dịch HCl 2M cần dùng:
\(V_{HCl\left(2M\right)}=\dfrac{0,8}{2}=0,4\left(l\right)\)
c) 0,4l = 400ml
Khối lượng dung dịch HCl 2M cần dùng là:
\(m_{HCl\left(2M\right)}=V_{HCl\left(2M\right)}.D_{HCl\left(2M\right)}=400.1,12=448\left(g\right)\)
Dung dịch thu được sau phản ứng có chứa muối FeCl2 và AlCl3
Khối lượng của dung dịch sau phản ứng là:
\(m_{dd}=m_{hh}+m_{HCl}-m_{H_2}=11+488-0,8=458,2\left(g\right)\)
theo PTHH \(n_{FeCl_2}=n_{Fe}=0,1\left(mol\right)\\ n_{AlCl_3}=n_{Al}=0,2\left(mol\right)\)
Khối lượng FeCl2 và AlCl3 thu được là:
\(m_{FeCl_2}=0,1.127=12,7\left(g\right)\\ m_{AlCl_3}=0,2.133,5=26,7\left(g\right)\)
Nồng độ phần trăm các dung dịch thu được là:
\(C\%_{FeCl_2}=\dfrac{12,7}{458,2}\cdot100\approx2,77\%\\ C\%_{AlCl_3}=\dfrac{26,7}{458,2}\approx5,83\%\)
Đúng 0
Bình luận (2)
Hòa tan 36,5 gam HCl vào nước, thu được 500ml dung dịch có khối lượng riêng D = 1,1 g/ml. Tính nồng độ mol và nồng độ phần trăm của dung dịch thu được.
: Cho Fe phản ứng với 200ml dd CuSO4 1M.
a/ Viết PTHH và tính khối lượng Fe tham gia phản ứng?
b/ Tính nồng độ phần trăm của dd CuSO4 tham gia phản ứng. Biết khối lượng riêng của CuSO4 là 1,206 g/ml.
\(n_{CuSO_4}=1.0,2=0,2(mol)\\ a,PTHH:Fe+CuSO_4\to FeSO_4+Cu\\ \Rightarrow n_{Fe}=0,2(mol)\\ \Rightarrow m_{Fe}=0,2.56=11,2(g)\\ b,m_{dd_{CuSO_4}}=200.1,206=241,2(g)\\ \Rightarrow C\%_{CuSO_4}=\dfrac{0,2.160}{241,2}.100\%=13,27\%\)
Đúng 2
Bình luận (0)