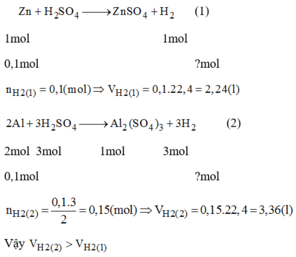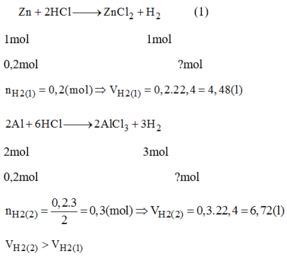So sánh thể tích khí hidro (dktc) thu được trong trường hợp sau: 0,1mol Zn tác dụng với dung dịch H²SO⁴ loãng 0,1 mol Al tác dụng với dung dịch H²SO⁴ loãng

Những câu hỏi liên quan
So sánh thể tích khí hidro ( đktc) thu được trong mỗi trường hợp sau:
0,1 mol Zn tác dụng với dung dịch H 2 S O 4 loãng, dư.
0,1 mol Al tác dụng với dung dịch H 2 S O 4 loãng, dư
So sánh thể tích khí hidro ( đktc) thu được trong mỗi trường hợp sau:
0,2 mol Zn tác dụng với dung dịch HCl dư
0,2 Al tác dụng với dung dịch HCl dư.
So sánh thể tích khí hiđro (cùng điều kiện t
°
và p) thu được của từng cặp phản ứng trong những thí nghiệm sau :Thí nghiệm 1:0,1 mol Zn tác dụng với dung dịch HCl dư.0,1 mol Zn tác dụng với dung dịch
H
2
SO
4
dư.Thí nghiệm 2 :0,1 mol
H
2
SO...
Đọc tiếp
So sánh thể tích khí hiđro (cùng điều kiện t ° và p) thu được của từng cặp phản ứng trong những thí nghiệm sau :
Thí nghiệm 1:
0,1 mol Zn tác dụng với dung dịch HCl dư.
0,1 mol Zn tác dụng với dung dịch H 2 SO 4 dư.
Thí nghiệm 2 :
0,1 mol H 2 SO 4 tác dụng với Zn dư.
0,1 mol HCl tác dụng với Zn dư.
So sánh thể tích khí hiđro sinh ra
TN1 : Dùng dư axit để toàn lượng Zn tham gia phản ứng.
Theo (1) : 0,1 mol Zn điều chế được 0,1 mol H 2
Theo (2) : 0,1 mol Zn điều chế được 0,1 mol H 2
Kết luận : Những thể tích khí hiđro thu được trong thí nghiệm 1 là bằng nhau.
TN 2 - Dùng dư Zn để toàn lượng axit tham gia phản ứng.
Theo (1) : 0,1 mol HCl điều chế được 0,05 mol H 2
Theo (2) : 0,1 mol H 2 SO 4 điều chế được 0,1 mol H 2
Kết luận . Những thể tích khí hiđro thu được trong thí nghiệm 2 là không bằng nhau. Thể tích khí hiđro sinh ra ở (2) nhiều gấp 2 lần ở (1).
Đúng 0
Bình luận (0)
cho hỗn hợp gồm Fe,Al,Cu có số mol bằng nhau và đều bằng 0,1 mol tác dụng với dung dịch H2SO4 loãng dư,thể tích thu được ở dktc
\(Fe + H_2SO_4 \to FeSO_4 + H_2\\ 2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2\\ n_{H_2} = n_{Fe} + \dfrac{3}{2}n_{Al} = 0,25(mol)\\ V_{H_2} = 0,25.22,4 = 5,6(lít)\)
Đúng 2
Bình luận (0)
Cho 0,1 mol Zn tác dụng hoàn toàn với dung dịch HCl thì thể tích khí hidro thu được ở đktc là?
Zn+2HCl->ZnCl2+H2
0,1-------------------0,1
=>VH2=0,1.22,4=2,24l
Đúng 2
Bình luận (0)
Cho cùng một lượng các kim loại Al, Zn, Mg lần lượt tác dụng hết với dung dịch H 2 SO 4 loãng, sau phản ứng thu được muối sunfat (tạo bởi kim loại kết hợp với nhóm SO 4 ) và khí H 2 . Vậy thể tích khí H 2 thoát ra từ kim loại nào lớn nhất?
có ai giúp mik ik
Gọi mMg = mZn = mFe = a(g)
\(n_{Mg}=\dfrac{a}{24}\left(mol\right),n_{Al}=\dfrac{a}{27}\left(mol\right)\\ n_{Zn}=\dfrac{a}{65}\left(mol\right),n_{Fe}=\dfrac{a}{56}\left(mol\right)\\ Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
\(\dfrac{a}{24}\) --> \(\dfrac{a}{24}\left(mol\right)\) (1)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(\dfrac{a}{27}\) --> \(\dfrac{a}{16}\left(mol\right)\) (2)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(\dfrac{a}{65}\) --> \(\dfrac{a}{65}\left(mol\right)\) (3)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(\dfrac{a}{56}\) --> \(\dfrac{a}{56}\left(mol\right)\) (4)
Từ (1),(2),(3),(4) có: \(\dfrac{a}{16}>\dfrac{a}{24}>\dfrac{a}{56}>\dfrac{a}{65}\)
Vậy \(V_{H_2}\) thoát ra từ kim loại \(Al\) là lớn nhất
Đúng 0
Bình luận (0)
Bài 1 : cho 250 ml dung dịch CH3COOH tác dụng với kim loại Zn dư, sau phản ứng thu được 14,2 g muối khan
a) tính thể tích khí hidro sinh ra ở điều kiện tiêu chuẩn
b) tính nồng độ mol của dung dịch CH3COOH đã dùng
Bài 2 : cho kim loại sắt tác dụng dung dịch có chứa 4,5 g axit axetic
a) tính khối lượng muối thu được sau phản ứng
b) tính thể tích không khí cần dùng để đốt cháy hết lượng h2 sinh ra ở trên, (biết các thể tích khí đều đo ở điều kiện tiêu chuẩn, thể tích không khí gấp 5 lần thể tích O2...
Đọc tiếp
Bài 1 : cho 250 ml dung dịch CH3COOH tác dụng với kim loại Zn dư, sau phản ứng thu được 14,2 g muối khan a) tính thể tích khí hidro sinh ra ở điều kiện tiêu chuẩn b) tính nồng độ mol của dung dịch CH3COOH đã dùng Bài 2 : cho kim loại sắt tác dụng dung dịch có chứa 4,5 g axit axetic a) tính khối lượng muối thu được sau phản ứng b) tính thể tích không khí cần dùng để đốt cháy hết lượng h2 sinh ra ở trên, (biết các thể tích khí đều đo ở điều kiện tiêu chuẩn, thể tích không khí gấp 5 lần thể tích O2 )
Bài 5
Fe + 2CH3COOH \(\rightarrow\) (CH3COO)2Fe + H2(1)
nCH3COOH = \(\dfrac{4,5}{60}=0,075mol\)
a) THeo pt: n(CH3COO)2Fe = \(\dfrac{1}{2}.nCH_3COOH=0,0375mol\)
=> m = 6,525g
c) Theo pt (1) nH2 = 1/2nCH3COOH = 0,0375 mol
2H2 + O2 \(\xrightarrow[]{t^o}\) 2H2O
Theo pt: nO2 = 0,5nH2 = 0,01875mol
=> VO2 = 0,42 lít
=> Vkk = 0,42.5 = 2,1 lít
Đúng 0
Bình luận (0)
Cho 20,4g hỗn hợp X gồm Al , Zn và Fe tác dụng với dung dịch HCl dư thu được 10,08 lit H2. Mặt khác 0,2 mol hỗn hợp X tác dụng vừa đủ với 6,16 lit Cl2. Tính thành phần % về khối lượng của Al trong hỗn hợp X ( biết khí thu được đều đo ở dktc) A. 33,09% B. 26,47% C. 19,85% D. 13,24%
Đọc tiếp
Cho 20,4g hỗn hợp X gồm Al , Zn và Fe tác dụng với dung dịch HCl dư thu được 10,08 lit H2. Mặt khác 0,2 mol hỗn hợp X tác dụng vừa đủ với 6,16 lit Cl2. Tính thành phần % về khối lượng của Al trong hỗn hợp X ( biết khí thu được đều đo ở dktc)
A. 33,09%
B. 26,47%
C. 19,85%
D. 13,24%
Đáp án : D
Gọi số mol Al ; Zn ; Fe lần lượt là x ; y ; z
=> 27x + 65y + 56z = 20,4 (1)
Và 1,5x + y + z = nH2 = 0,45 (2)
Xét 0,2 mol X có lượng chất gấp t lần 20,4g X
=> t(x + y +z) = 0,2 mol (3)
Lại có : Bảo toàn e : 2nCl2 = (3x + 2y + 3z)t = 0,55 (4)
Từ (1),(2),(3),(4) => x = y = 0,1 ; z = 0,2
=> %mAl(X) = 13,24%
Đúng 0
Bình luận (0)
Cho một lượng hỗn hợp Mg và Al tác dụng với dung dịch H2 SO4 loãng dư thu được 11,2 lít H2 . Mặt khác cho lượng hỗn hợp trên tác dụng với dung dịch KOH thì thu được 6,72 lít H2 . biết rằng các thể tích khí đều do ở dktc. viết phương trình hóa học của các phản ứng đã xảy ra. tính khối lượng mỗi kim loại trong hỗn hợp đã dùng
\(n_{H_2\left(1\right)}=\dfrac{6.72}{22.4}=0.3\left(mol\right)\)
\(n_{H_2\left(2,3\right)}=\dfrac{11.2}{22.4}=0.5\left(mol\right)\)
\(2Al+2KOH+2H_2O\rightarrow2KAlO_2+3H_2\)
\(0.2....................................................0.3\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(0.2............................................0.15\)
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
\(0.35..............................0.5-0.15\)
\(m_{Al}=0.2\cdot27=5.4\left(g\right)\)
\(m_{Mg}=0.35\cdot24=8.4\left(g\right)\)
Đúng 2
Bình luận (0)