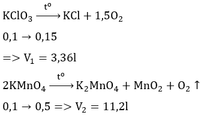So sánh số mol khí oxi điều chế được = sự phân hủy cùng số mol của KMnO4 và KClO3

Những câu hỏi liên quan
a, Tính toán để biết chất nào giàu oxi hơn: KMnO4, KClO3,KNO3
b, So sánh số mol khí Oxi điều chế được bằng sự phân hủy cùng số mol của mỗi chất nói trên
c, Có nhận xét gì về sự so sánh kết quả của câu a và b
Để điều chế khí oxi người ta phân hủy KMnO4 và KCLO3 a/Để thu được lượng khí oxi như nhau,chất nào cần số mol nhiều hơn?Cần dùng khối lượng nhiều hơn? b/phân hủy cùng số mol,chất nào sinh ra khí nhiều hơn? c/phân hủy cùng khối lượng chất nào sinh ra khí oxi nhiều hơn? d/Biết giá thành 1kg KMnO4 là 200000đ,1kg KCLO3 là 300000đ,hãy cho biết để điều chế khí oxi như nhau,thì dùng chất nào có giá thành rẻ nhiều hơn?
Đọc tiếp
Để điều chế khí oxi người ta phân hủy KMnO4 và KCLO3
a/Để thu được lượng khí oxi như nhau,chất nào cần số mol nhiều hơn?Cần dùng khối lượng nhiều hơn?
b/phân hủy cùng số mol,chất nào sinh ra khí nhiều hơn?
c/phân hủy cùng khối lượng chất nào sinh ra khí oxi nhiều hơn?
d/Biết giá thành 1kg KMnO4 là 200000đ,1kg KCLO3 là 300000đ,hãy cho biết để điều chế khí oxi như nhau,thì dùng chất nào có giá thành rẻ nhiều hơn?
a)6KMnO4--->3K2MnO4 + 3MnO2 + 3O2 (1)
2KClO3---> 2KCl + 3O2 (2)
Dựa vào phương trình trên ---> thu cùng lượng O2, KMnO4 cần nhiều số mol hơn, và khối lượng nhiều hơn.
b)6KClO3-->6KCl + 9O2 (3)
1,3--->Cùng số mol, KClO3 cho nhiều O2 hơn.
c)Giả sử cả 2 chất cùng có khối lượng là 100g
nKMnO4=50/79(mol)
nKClO3=40/49
Thay vào các phương trình phản ứng tính ra mO2
Cụ thể: KMnO4 cho ra 800/79 (g) O2
KClO3 cho ra 1920/49 (g) O2
---> Cùng m thì KClO3 cho nhiều g O2 hơn.
d) Giả sử cần điều chế 32 g O2
--->nO2=1 mol
--->nKMnO4=2 mol--->mKMnO4=316g
và nKClO3=2/3 mol--->nKClO3=245/3g
Ta có:
-1000g KMnO4 <=> 200000đ
316 g=========>63200đ
-1000g KClO3 <=> 300000đ
245/3g========> 24500đ
Vậy để điều chế cùng lượng O2, KClO3 có giá thành rẻ hơn.
Đúng 0
Bình luận (0)
a) Tính % oxi trong các chất sau: KMnO4, KCLO3, KNO3
b) So sánh số mol oxi điều chế được bằng sự phân huỷ số mol của mỗi chất trên
c) Phân huỷ cùng số mol của các chất trên có phải chất có hàm lượng oxi cao cho nhiều oxi
a) %O trong KMnO4=\(\frac{16.4}{40+24+16.4}.100=50\%\)
%O trong KClO3= \(\frac{16.3}{40+35,5+16.3}.100=38,9\%\)
%O trong KNO3=\(\frac{16.3}{40+14+16.3}.100=47,1\%\)
Đúng 1
Bình luận (2)
So sánh số mol khí oxi điều chế được = sự phân hủy cùng khối lượng của KMnO4 và KClO3
Trong phòng thí nghiệm có thể dùng muối KClO3 hoặc KMnO4 để điều chế oxi bằng phản ứng phân hủy. Viết phương trình hóa học của các phản ứng và tính thể tích khí oxi thu được (đktc) khi nhiệt phân hoàn toàn 0,1 mol mỗi chất trên.
trong phòng thí nghiệm ngta thường nung KClO3 hoặc KMnO4 để điều chế khí oxi sử dụng cho các thí nghiệm khác, nếu ta sử dụng cùng số mol hai chất này để điều chế khí oxi thì trường hợp nào sẽ thu được khối lượng khí oxi là nhiều nhất? giải thích.
\(2KMnO_4\underrightarrow{^{t^0}}K_2MnO_4+MnO_2+O_2\)
\(\dfrac{a}{158}.............................\dfrac{a}{79}\)
\(2KClO_3\underrightarrow{^{t^0}}2KCl+3O_2\)
\(\dfrac{a}{122.5}............\dfrac{3a}{245}\)
\(TC:\)
\(\dfrac{a}{79}>\dfrac{3a}{245}\)
=> Lượng Cl2 điều chế từ KMnO4 lớn nhất.
Đúng 2
Bình luận (0)
Nếu lấy cùng một lượng (số mol) KClO3 và KMnO4 để điều chế khí oxygen thì chất nào sẽ cho nhiều khí oxygen hơn?
Giả sử ta lấy cùng một khối lượng là a gam
\(n_{KClO_3}=\dfrac{m_{KClO_3}}{M_{KClO_3}}=\dfrac{a}{122,5}\left(mol\right)\)
\(n_{KMnO_4}=\dfrac{m_{KMnO_4}}{M_{KMnO_4}}=\dfrac{a}{158}\left(mol\right)\)
\(2KClO_3\xrightarrow[]{t^o}2KCl+3O_2\) (1)
Theo phương trình:
\(n_{O_2\left(1\right)}=\dfrac{3}{2}n_{KClO_3}=\dfrac{3}{2}.\dfrac{a}{122,5}=\dfrac{3a}{245}\)
\(2KMnO_4\xrightarrow[]{t^2}K_2MnO_4+MnO_2+O_2\) (2)
Theo phương trình:
\(n_{O_2\left(2\right)}=\dfrac{1}{2}n_{KMnO_4}=\dfrac{1}{2}.\dfrac{a}{158}=\dfrac{a}{316}\left(mol\right)\)
Ta thấy: \(\dfrac{a}{316}< \dfrac{a}{245}\)
\(\Rightarrow n_{O_2\left(2\right)}< n_{O_2\left(2\right)}\)
Vậy khi nhiệt phân cùng 1 lượng chất cho nhiều oxi hơn là KClO3
Đúng 1
Bình luận (0)
\(PTHH:2KClO_3\underrightarrow{to}2KCL+3O_2\uparrow\)
\(2KMnO_4\underrightarrow{to}K_2MnO_4+MnO_2+O_2\uparrow\)
Từ PTHH trên ta thấy đc rằng:
\(KClO_3\) sẽ điều chế khí oxygen nhiều hơn do phân huỷ nhiều Oxygen
Đúng 0
Bình luận (0)
Những hợp chất nào sau đâycó thể dùng điều chế oxi trong phòng thí nhiệm:KMnO4,KClO3,KnO3,HgO.Tính thể tích khí oxi thu được(đktc)khi nung(khi phân hủy).
a.0,5 mol mỗi chất trên?
b.50g mỗi chất KnO3 hoặc HgO?
a)
2KMnO4 -to-> K2MnO4 + MnO2 + O2
0.5__________________________0.25
VO2 = 0.25*22.4 = 5.6 (l)
2KClO3 -to-> 2KCl + 3O2
0.5_______________0.75
VO2 = 0.75*22.4 = 16.8 (l)
2KNO3 -to-> 2KNO2 + O2
0.5________________0.25
VO2 = 0.25*22.4 = 5.6 (l)
2HgO -to-> 2Hg + O2
0.5____________0.25
VO2 = 0.25*22.4 = 5.6 (l)
b)
nKNO3 = 50/101 (mol)
2KNO3 -to-> 2KNO2 + O2
50/101______________25/101
VO2 = 25/101 * 22.4 = 5.54 (l)
nHgO = 50/217 (mol)
2HgO -to-> 2Hg + O2
50/217 _________25/217
VO2 = 2.58 (l)
Đúng 1
Bình luận (0)
Trong phòng thí nghiệm khí oxi được điều chế bằng cách nhiệt phân KMnO4 và KClO3. Hãy tính tỉ lệ khối lượng giữa KMnO4 và KClO3 để thu được lượng oxi bằng nhau
\(Coi\ n_{O_2} = 3(mol)\\ 2KMnO_4 \xrightarrow K_2MnO_4 + MnO_2+ O_2\\ n_{KMnO_4} = 2n_{O_2} = 6(mol)\\ 2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2\\ n_{KClO_3} = \dfrac{2}{3}n_{O_2} = 2(mol)\\ \dfrac{m_{KMnO_4}}{m_{KClO_3}} = \dfrac{6.158}{2.122,5} = 3,869\)
Đúng 1
Bình luận (0)
\(2KMnO_4\underrightarrow{^{t^0}}K_2MnO_4+MnO_2+O_2\)
\(2a................................a\)
\(2KClO_3\underrightarrow{^{t^0}}2KCl+3O_2\)
\(\dfrac{2a}{3}..................a\)
\(m_{KMnO_4}=2a\cdot158=316a\left(g\right)\)
\(m_{KClO_3}=\dfrac{2}{3}a\cdot122.5=\dfrac{245a}{3}\left(g\right)\)
\(\dfrac{m_{KMnO_4}}{m_{KClO_3}}=\dfrac{316a}{\dfrac{245a}{3}}=\dfrac{948}{245}\)
Đúng 0
Bình luận (0)