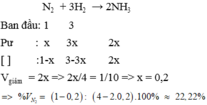Những câu hỏi liên quan
Trộn 10 lít N2 với 40 lít H2 rồi nung nóng một thời gian, sau đó đưa về to và áp suất ban đầu thấy thu được 42 lít hỗn hợp A gồm N2, H2 và NH3.
a/ Tính thể tích H2 đã phản ứng.
b/ Tính hiệu suất phản ứng.
c/ Tính thể tích mỗi khí trong hỗn hợp A.
N2 + 3H2 → 2NH3
Cứ 1 lít N2 phản ứng với 3 lít H2 tạo thành 2 lít NH3 thì thể tích giảm:
3 + 1 - 2 = 2 (lít)
Ở đây, tổng thể tích khí trước và sau phản ứng (đo cùng điều kiện) là 50 lít và 48 lít, tức giảm 2 lít.
Vậy V(NH3) = 2 lít
Nếu phản ứng hoàn toàn (100%) thì N2 phản ứng hết và H2 dư. Hiệu suất được tính theo N2:
H = (1/10).100% = 10%
*TK
Đúng 1
Bình luận (1)
Trong một bình kín chứa 8 mol khí H2 và 3 mol khí N2 và một ít bột Ni làm xúc tác. Nung nóng bình trong một thời gian tới khi có 60% thể tích H2 phản ứng thì thu được hỗn hợp khí A (gồm N2, H2 và NH3).
a/ Tính thể tích NH3 tạo thành (đktc).
b/ Tính tỉ khối của A đối với H2.
a) \(N_2+3H_2-^{t^o}\rightarrow2NH_3\)
3..........8
Lập tỉ lệ \(\dfrac{3}{1}>\dfrac{8}{3}\) => Tính theo số mol H2
\(n_{H_2\left(pứ\right)}=8.60\%=4,8\left(mol\right)\)
=> \(n_{NH_3}=\dfrac{4,8.2}{3}=3,2\left(mol\right)\)
=> \(V_{NH_3}=3,2.22,4=71,68\left(l\right)\)
b) Hỗn hợp A gồm N2 dư, H2 dư, NH3
\(n_{N_2\left(dư\right)}=3-\dfrac{4,8}{3}=1,4\left(mol\right)\)
\(n_{H_2\left(dư\right)}=8-4,8=3,2\left(mol\right)\)
\(M_A=\dfrac{3,2.2+1,4.28+3,2.17}{3,2+1,4+3,2}=12,82\)
=>dA/H2 \(=\dfrac{12,82}{2}=6,41\)
Đúng 2
Bình luận (0)
1/ Hỗn hợp khí A gồm N2 và H2 có tỉ khối đối với hidro là 8.a) Tính % thể tích mỗi khí trong hỗn hợp.b) Người ta cho 11,2 lít A vào bình thép rồi bật tia lửa điện để thực hiện phản ứng giữa N2 và H2, tạo khí NH3. Sau một thời gian, hỗn hợp thu được có tỉ khối đối với hiđro là 6,5. Tính hiệu suất của phản ứng trên.
Đọc tiếp
1/ Hỗn hợp khí A gồm N2 và H2 có tỉ khối đối với hidro là 8.
a) Tính % thể tích mỗi khí trong hỗn hợp.
b) Người ta cho 11,2 lít A vào bình thép rồi bật tia lửa điện để thực hiện phản ứng giữa N2 và H2, tạo khí NH3. Sau một thời gian, hỗn hợp thu được có tỉ khối đối với hiđro là 6,5. Tính hiệu suất của phản ứng trên.
Cho 17,5 lít H2 và 5 lít N2 vào 1 bình phản ứng. Sau phản ứng thu được hỗn hợp khí A gồm N2 H2 NH3( các thể tích khí đo trong cùng điều kiện nhiệt dộ và áp suất ) biết dA/h2=5 . Tính hiệu suất tổng hợp NH3 và thể tích NH3 thu được sau phản ứng.
Xem chi tiết
1. Cho 17,5 lít H2 và 5 lít N2 vào một bình phản ứng. Sau phản ứng thu được hỗn hợp khí A gồm NH3, N2 và H2 ( các thể tích khí đo trong cùng điều kiện nhiệt độ và áp suất). Biết dA/H2 5 Tính hiệu suất tổng hợp NH3 và thể tích khí NH3 thu được sau phản ứng.2. Cho m gam hỗn hợp 2 kim loại Mg và Al có số mol bằng nhau phản ứng hoàn toàn với lượng oxi dư. Kết thúc phản ứng thu được hỗn hợp chất rắn có khối lượng tăng so với hỗn hợp ban đầu là 2 g. Tín
Đọc tiếp
1. Cho 17,5 lít H2 và 5 lít N2 vào một bình phản ứng. Sau phản ứng thu được hỗn hợp khí A gồm NH3, N2 và H2 ( các thể tích khí đo trong cùng điều kiện nhiệt độ và áp suất). Biết dA/H2 = 5 Tính hiệu suất tổng hợp NH3 và thể tích khí NH3 thu được sau phản ứng.
2. Cho m gam hỗn hợp 2 kim loại Mg và Al có số mol bằng nhau phản ứng hoàn toàn với lượng oxi dư. Kết thúc phản ứng thu được hỗn hợp chất rắn có khối lượng tăng so với hỗn hợp ban đầu là 2 g. Tín
1. Cho 17,5 lít H2 và 5 lít N2 vào một bình phản ứng. Sau phản ứng thu được hỗn hợp khí A gồm NH3, N2 và H2 ( các thể tích khí đo trong cùng điều kiện nhiệt độ và áp suất). Biết dA/H2=5 Tính hiệu suất tổng hợp NH3 và thể tích khí NH3 thu được sau phản ứng.
H=50%H=50%
Giải thích các bước giải:
3N2+H2t∘,p,xt−−−→2NH33N2+H2→t∘,p,xt2NH3
Xét:
Đúng 0
Bình luận (2)
Cho 17,5 lít H2 và 5 lít N2 vào một bình phản ứng. Sau phản ứng thu được hỗn hợp khí A gồm NH3, N2 và H2 (các thể tích khí đo trong cùng điều kiện nhiệt độ và áp suất). Biết dA/H2 = 5. Tính hiệu suất tổng hợp NH3 và thể tích khí NH3 thu được sau phản ứng.
\(M_A=5.2=10\left(g/mol\right)\)
Do các khí đo ở cùng điều kiện nhiệt độ và áp suất nên tỉ lệ thể tích cũng là tỉ lệ mol
Chọn \(\left\{{}\begin{matrix}n_{H_2}=17,5\left(mol\right)\\n_{N_2}=5\left(mol\right)\end{matrix}\right.\)
Gọi \(n_{N_2\left(p\text{ư}\right)}=a\left(mol\right)\left(0< a< 5\right)\)
PTHH: \(N_2+3H_2\xrightarrow[]{t^o,p,xt}2NH_3\)
a---->3a---------->2a
Xét tỉ lệ: \(5< \dfrac{17,5}{3}\Rightarrow\) Hiệu suất phản ứng tính theo N2
Ta có: \(n_A=5+17,5+2a-a-3a=22,5-2a\left(mol\right)\)
Theo ĐLBTKL: \(m_A=5.28+17,5.2=175\left(g\right)\)
\(\Rightarrow M_A=\dfrac{175}{22,5-2a}=10\Leftrightarrow a=2,5\left(TM\right)\)
\(\Rightarrow H=\dfrac{2,5}{5}.100\%=50\%\)
Đúng 1
Bình luận (0)
Một hỗn hợp A gồm H2 và N2 có tỉ khối so với H2 lầ 3,6.Nung nóng hỗn hợp 1 thời gian với xúc tác thích hợp thu đc hỗn hợp khí B gồm N2,H2,NH3 có tỉ khối so với H2 là 4,5
a) Tính % thể tích hỗn hợp trước và sau phản ứng
b) tính hiệu suất của phản ứng
Đưa một hỗn hợp khí N2 và H2 có tỷ lệ 1: 3 vào tháp tổng hợp, sau phản ứng thấy thể tích khí đi ra giảm 1/10 so với ban đầu. Tính thành phần phần trăm về thể tích của hỗn hợp khí sau phản ứng A. 20%, 60%, 20% B. 22.22%, 66.67%, 11.11% C. 30%, 60%, 10% D. 33.33%, 50%, 16.67%
Đọc tiếp
Đưa một hỗn hợp khí N2 và H2 có tỷ lệ 1: 3 vào tháp tổng hợp, sau phản ứng thấy thể tích khí đi ra giảm 1/10 so với ban đầu. Tính thành phần phần trăm về thể tích của hỗn hợp khí sau phản ứng
A. 20%, 60%, 20%
B. 22.22%, 66.67%, 11.11%
C. 30%, 60%, 10%
D. 33.33%, 50%, 16.67%