Cho 23,8 g hỗn hợp X gồm Cu; Al : Fe tác dụng vừa hết 14,56 l Cl2(đktc) Mặt khác cứ 0,25 mol hỗn hợp X vào HCl dư thì được 0,2 mol khí .Tính thành phần phần trăm khối lượng của kim loại ban đầu

Những câu hỏi liên quan
cho m g Fe tác dụng tối đa với 1,12l hỗn hợp X gồm Cl2,O2 (tỉ khối hơi của hỗn hợp so với H2 bằng 23,8) ở nhiệt độ thích hợp thu được hỗn hợp rắn Y gồm muối và một oxit.Tính giá trị của m
\(n_{Cl_2} = a(mol) ; n_{O_2} = b(mol)\\ n_X = a + b = \dfrac{1,12}{22,4} = 0,05(mol)\\ m_X = 71a + 32b = 0,05.2.23,8 = 2,38(gam)\\ \Rightarrow a = 0,02 ; b = 0,03\)
Bảo toàn electron :
\(3n_{Fe} = 2n_{Cl_2} + 4n_{O_2}\\ \Rightarrow n_{Fe} = \dfrac{0,02.2 + 0,03.4}{3} = \dfrac{4}{75}(mol)\\ \Rightarrow m = \dfrac{4}{75}.160 = 8,53(gam)\)
Đúng 1
Bình luận (0)
Bài 23: Cho 23,8 gam hỗn hợp X gồm Mg, Fe và Al tác dụng hoàn toàn với dung dịch HCl dư thì thu được 17,92 lit khí ở đktc. Mặt khác, cho 23,8 gam hỗn hợp X tác dụng vừa đủ với 20,16 lít khí Cl2 ở đktc. Tính khối lượng từng chất trong hỗn hợp X?
Gọi số mol Mg, Fe, Al là a, b, c
=> 24a + 56b + 27c = 23,8
PTHH: Mg + 2HCl --> MgCl2 + H2
a------------------------->a
Fe + 2HCl --> FeCl2 + H2
b------------------------->b
2Al + 6HCl --> 2AlCl3 + 3H2
c------------------------->1,5c
=> a + b + 1,5c = \(\dfrac{17,92}{22,4}=0,8\left(mol\right)\)
PTHH: Mg + Cl2 --to--> MgCl2
a-->a
2Fe + 3Cl2 --to--> 2FeCl3
b--->1,5b
2Al + 3Cl2 --to--> 2AlCl3
c--->1,5c
=> \(a+1,5b+1,5c=\dfrac{20,16}{22,4}=0,9\left(mol\right)\)
=> a = 0,3; b = 0,2; c = 0,2
=> \(\left\{{}\begin{matrix}m_{Mg}=0,3.24=7,2\left(g\right)\\m_{Fe}=0,2.56=11,2\left(g\right)\\m_{Al}=0,2.27=5,4\left(g\right)\end{matrix}\right.\)
Đúng 3
Bình luận (0)
Cho 23,8 gam hỗn hợp X (Cu, Fe, Al) tác dụng vừa đủ 14,56 lít khí Cl2 (đktc). Mặt khác cứ 0,25 Mol hỗn hợp tác dụng với dung dịch HCl dư thu được 0,2 Mol khí ( đktc). Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp X.
Gọi số mol của Cu, Fe, Al trong 23,8 gam hhX lần lượt là x, y, z mol
→ mX = 64x + 56y + 27z = 23,8 (1)
\(n_{Cl_2}\) = x + 1,5y + 1,5z = 0,65 (2)
0,25 mol X + HCl → 0,2 mol H2 nên 0,2.(x + y + z) = 0,25.(y + 1,5z) (3)
Từ (1), (2), (3) => x = 0,2 mol; y = 0,1 mol; z = 0,2 mol
\(\%_{Cu} = \dfrac{0,2. 64}{23,8} \approx 53,78\%\)
\(\%_{Fe} = \dfrac{0,1 .56}{23,8} \approx 23,53\%\)
%Al ≈ 22,69%
Đúng 3
Bình luận (1)
Cho hỗn hợp X gồm 4,08g Mg và 2,7g Al tác dụng vừa đủ với V lít (đktc) hỗn hợp khí Y gồm Cl2 và O2(có tỉ khối so với H2 là 23,8), thu được m gam hỗn hợp rắn Z. Giá trị m là
\(n_{Mg}=\dfrac{4,08}{24}=0,17\left(mol\right)\)
\(n_{Al}=\dfrac{2,7}{27}=0,1\left(mol\right)\)
Gọi số mol Cl2 và O2 là a, b
Mg0-2e-->Mg+2
0,17->0,34
Al0-3e-->Al+3
0,1->0,3
Cl20 +2e--> 2Cl-
a--->2a
O20 +4e --> 2O2-
b--->4b
Bảo toàn e: 2a + 4b = 0,64
Có \(\dfrac{71a+32b}{a+b}=23,8.2=47,6\)
=> a = 0,08; b = 0,12
=> mZ = 4,08 + 2,7 + 0,08.71 + 0,12.32 = 16,3 (g)
Đúng 1
Bình luận (0)
ai giúp vs ạ
Đốt cháy 23,8 gam hỗn hợp X gồm Al và Zn cần dùng V lít O 2 thu được 36,6 g hỗn hợp Al 2 O 3 và ZnO. Giá trị của V là
A.
2,24 lít.
B.
4,48 lít.
C.
8,96 lít.
D.
3,36 lít. em đang cần gấp ạ
cho 14,4 g hỗn hợp X gồm Cu và CuO tác dụng vừa đủ với 500ml dd HCl 0,4 M . tính khối lượng Cu trong hỗn hợp ban đầu.
CuO+2HCl--->CuCl2+H2O
n HCl=0,5.0,4=0,2(mol)
Theo pthh
n CuO=1/2n HCl=0,1(mol)
m CuO=0,1.80=8(g)
m Cu=14,4-8=6,4(g)
PTHH :
CuO + 2HCl ----------> CuCl2 + H2O (1)
nHCl = (500/1000) . 0,4 = 0,2 (mol)
Theo (1) : n CuO = 1/2nHCl = 0,2.1/2 = 0,1 (mol)
=> mCuO = 0,1 .80 = 8 (g)
=> m Cu = 14,4 -8 = 6,4 (g)
Cho 25,6g hỗn hợp X gồm Fe, Mg, Cu trong đó số mol Mg bằng số mol Cu. Mặt khác 1 mol hỗn hợp X tác dụng vừa đủ với 13,44 lít oxi ở (đktc) tạo ra hỗn hợp sản phẩm gồm Fe3O4, MgO, CuO. Tính khối lượng từng kim loại trong 25,6 g hh X.
Gọi a, b, b là mol Fe, Mg, Cu trong 25,6g X
\(\Rightarrow56a+24b+64b=25,6\left(1\right)\)
Gọi ka, kb, kb là mol Fe, Mg, Cu trong 1 mol X (k > 0)
\(\Rightarrow k\left(a+b+c\right)=1\left(+\right)\)
\(n_{O2}=0,6\left(mol\right)\)
\(3Fe+2O_2\underrightarrow{^{to}}Fe_3O_4\)
\(2Mg+O_2\underrightarrow{^{to}}2MgO\)
\(2Cu+O_2\underrightarrow{^{to}}2CuO\)
\(\Rightarrow k.\left(\frac{2a}{3}+0,5b+0,5b\right)=0,6\left(++\right)\)
Từ (+)(++) \(\Rightarrow k=\frac{1}{a+b+b}=\frac{0,6}{\frac{2a}{3}+0,5b+0,5b}\)
\(\Rightarrow0,6\left(a+2b\right)=\frac{2a}{3}+b\)
\(\Rightarrow\frac{-a}{15}+0,2b=0\left(2\right)\)
Từ (1)(2) \(\Rightarrow\left\{{}\begin{matrix}a=0,3\\b=0,1\end{matrix}\right.\)
\(m_{Fe}=0,3.56=16,8\left(g\right)\)
\(m_{Mg}=0,1.24=2,4\left(g\right)\)
\(m_{Cu}=0,1.64=6,4\left(g\right)\)
Hỗn hợp khí X gồm oxi và clo có tỉ khối đối với hidro là 23,8 . Để phản ứng hết với 7,8 gam hỗn hợp Y gồm Mg và Al cần vừa hết 5,6 lít khí X ( đktc ) . Mặt khác 7,8 gam Y cũng phản ứng vừa hết với hỗn hợp Z gồm 2 halogen ở hai chu kì liên tiếp trong bảng tuần , thu được 54 gam muối .
a . Tính khối lượng mỗi kim loại có trong Y.
b . Xác định hai halogen và tính tỉ khối hơi của Z so với hidro . giúp em giải bài này vs ạ
Đọc tiếp
Hỗn hợp khí X gồm oxi và clo có tỉ khối đối với hidro là 23,8 . Để phản ứng hết với 7,8 gam hỗn hợp Y gồm Mg và Al cần vừa hết 5,6 lít khí X ( đktc ) . Mặt khác 7,8 gam Y cũng phản ứng vừa hết với hỗn hợp Z gồm 2 halogen ở hai chu kì liên tiếp trong bảng tuần , thu được 54 gam muối . a . Tính khối lượng mỗi kim loại có trong Y. b . Xác định hai halogen và tính tỉ khối hơi của Z so với hidro . giúp em giải bài này vs ạ
a)
Gọi số mol O2, Cl2 là a, b (mol)
=> \(\left\{{}\begin{matrix}a+b=\dfrac{5,6}{22,4}=0,25\\\overline{M}=\dfrac{32a+71b}{a+b}=23,8.2=47,6\end{matrix}\right.\)
=> a = 0,15; b = 0,1
Gọi số mol Mg, Al là x, y (mol)
=> 24x + 27y = 7,8 (1)
Mg0 - 2e --> Mg+2
x---->2x
Al0 - 3e --> Al+3
y--->3y
O20 + 4e --> 2O-2
0,15->0,6
Cl20 + 2e --> 2Cl-
0,1-->0,2
Bảo toàn e: 2x + 3y = 0,8 (2)
(1)(2) => x = 0,1; y = 0,2
=> \(\left\{{}\begin{matrix}m_{Mg}=0,1.24=2,4\left(g\right)\\m_{Al}=0,2.27=5,4\left(g\right)\end{matrix}\right.\)
b) Gọi công thức chung của 2 halogen là \(\overline{T_2}\)
\(m_{\overline{T_2}}=54-7,8=46,2\left(g\right)\)
Mg0 - 2e --> Mg+2
0,1---->0,2
Al0 - 3e --> Al+3
0,2-->0,6
\(\overline{T_2}+2e\rightarrow2\overline{T}^-\)
Bảo toàn e: \(n_{\overline{T_2}}=0,4\left(mol\right)\)
=> \(M_{\overline{T_2}}=\dfrac{46,2}{0,4}=115,5\left(g/mol\right)\)
Mà 2 halogen ở 2 chu kì liên tiếp
=> 2 halogen là Cl2, Br2
\(\overline{M}_Z=115,5\left(g/mol\right)\)
=> \(d_{Z/H_2}=\dfrac{115,5}{2}=57,75\)
Đúng 2
Bình luận (0)
Chia 23,8 gam hỗn hợp X gồm Al và Zn thành 2 phần bằng nhau. Phần 1 cho tác dụng hết với dung dịch HCl thu được 8,96 lít khí H2 (đktc). Phần 2 cho tác dụng với 300ml dung dịch Y chứa Cu(NO3)2 1M và AgNO3 1M đến khi phản ứng hoàn toàn thì thu được chất rắn Z. Số lượng kim loại trong Z là: A. 4 B. 3 C. 2 D. 1
Đọc tiếp
Chia 23,8 gam hỗn hợp X gồm Al và Zn thành 2 phần bằng nhau. Phần 1 cho tác dụng hết với dung dịch HCl thu được 8,96 lít khí H2 (đktc). Phần 2 cho tác dụng với 300ml dung dịch Y chứa Cu(NO3)2 1M và AgNO3 1M đến khi phản ứng hoàn toàn thì thu được chất rắn Z. Số lượng kim loại trong Z là:
A. 4
B. 3
C. 2
D. 1
Đáp án C
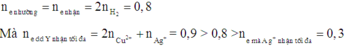
Do đó Ag+ phản ứng hết, Cu2+ phản ứng một phần và còn dư.
Khi đó Al và Zn đều phản ứng hết.
Suy ra Z chứa Cu và Ag.
Đúng 0
Bình luận (0)
























