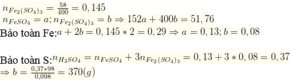hòa tan 14 g sắt bằng m gam dung dịch H2SO4 9,8% ( vừa đủ).Tính m

Những câu hỏi liên quan
Hòa tan hết 16 gam MO (M là kim loại) cần vừa đủ cần 200 gam dung dịch H2SO4 9,8% được dung
dịch X. Xác định M? Tính C% của chất tan trong dung dịch X?
\(m_{H_2SO_4}=\dfrac{200.9,8}{100}=19,6\left(g\right)=>n_{H_2SO_4}=\dfrac{19,6}{98}=0,2\left(mol\right)\)
PTHH: MO + H2SO4 --> MSO4 + H2O
____0,2<---0,2---------->0,2
=> \(M_{MO}=\dfrac{16}{0,2}=80\left(g/mol\right)\)
=> MM = 64 (g/mol)
=> M là Cu
\(C\%\left(CuSO_4\right)=\dfrac{0,2.160}{16+200}.100\%=14,815\%\)
Đúng 1
Bình luận (0)
Hòa tan hết a gam hỗn hợp X gồm Fe và một oxit sắt trong b gam dung dịch H2SO4 9,8% (lượng vừa đủ), sau phản ứng thu được dung dịch chứa 51,76 gam hỗn hợp hai muối khan. Mặt khác nếu hòa tan hết a gam X bằng dung dịch H2SO4 đặc nóng thì thu được duy nhất 58 gam muối Fe (III). Giá trị của b l A. 370 B. 220 C. 500 D. 420
Đọc tiếp
Hòa tan hết a gam hỗn hợp X gồm Fe và một oxit sắt trong b gam dung dịch H2SO4 9,8% (lượng vừa đủ), sau phản ứng thu được dung dịch chứa 51,76 gam hỗn hợp hai muối khan. Mặt khác nếu hòa tan hết a gam X bằng dung dịch H2SO4 đặc nóng thì thu được duy nhất 58 gam muối Fe (III). Giá trị của b l
A. 370
B. 220
C. 500
D. 420
Hòa tan hết a gam hỗn hợp X gồm Fe và một oxit sắt trong b gam dung dịch H2SO4 9,8% (lượng vừa đủ), sau phản ứng thu được dung dịch chứa 51,76 gam hỗn hợp hai muối khan. Mặt khác nếu hòa tan hết a gam X bằng dung dịch H2SO4 đặc nóng thì thu được duy nhất 58 gam muối Fe (III). Giá trị của b là: A. 370 B. 220 C. 500 D. 420
Đọc tiếp
Hòa tan hết a gam hỗn hợp X gồm Fe và một oxit sắt trong b gam dung dịch H2SO4 9,8% (lượng vừa đủ), sau phản ứng thu được dung dịch chứa 51,76 gam hỗn hợp hai muối khan. Mặt khác nếu hòa tan hết a gam X bằng dung dịch H2SO4 đặc nóng thì thu được duy nhất 58 gam muối Fe (III). Giá trị của b là:
A. 370
B. 220
C. 500
D. 420
Đáp án A
nFe = 2. 58/400 = 0,29 mol
nFeSO4 = x , nFe2(SO4)3 = y
⇒mdd = 152 x + 400y = 51,76
nFe = nFeSO4 +2.nFe2(SO4)3 = x+ 2y = 0,29
⇒x= 0,13 mol , y= 0,08 mol
BT S: nH2SO4 = nFeSO4 + 3Fe2(SO4)3 = 0,13 + 3.0,08 = 0,37
⇒b = 0,37.98/9,8% = 370g
Đúng 0
Bình luận (0)
Hòa tan hết a gam hỗn hợp X gồm Fe và một oxit sắt trong b gam dung dịch H2SO4 9,8% (lượng vừa đủ), sau phản ứng thu được dung dịch chứa 51,76 gam hỗn hợp hai muối khan. Mặt khác nếu hòa tan hết a gam X bằng dung dịch H2SO4 đặc nóng thì thu được duy nhất 58 gam muối Fe (III). Giá trị của b là: A. 370 B. 220 C. 500 D. 420
Đọc tiếp
Hòa tan hết a gam hỗn hợp X gồm Fe và một oxit sắt trong b gam dung dịch H2SO4 9,8% (lượng vừa đủ), sau phản ứng thu được dung dịch chứa 51,76 gam hỗn hợp hai muối khan. Mặt khác nếu hòa tan hết a gam X bằng dung dịch H2SO4 đặc nóng thì thu được duy nhất 58 gam muối Fe (III). Giá trị của b là:
A. 370
B. 220
C. 500
D. 420
Đáp án A
nFe2(SO4)3 = 58/400 = 0,145 mol
nFeSO4 = a ; nFe2(SO4)3 =b
⇒152a + 400b = 51,76
BT Fe: a + 2b = 0,145 . 2 = 0,29 ⇒ a= 0,13 mol; b= 0,08 mol
BT S: nH2SO4 = n FeSO4 + 3nFe2( SO4)3 = 0,13 + 3. 0,08 = 0,37
⇒b= 0,37 .98 /0,098 =370g
Đúng 0
Bình luận (0)
cứu em với, có một câu thôi!!!!!!!!!!!
1, Làm BT: Hòa tan 4g sắt (III) oxit bằng một lượng dung dịch H2SO4 9,8% (vừa đủ).
a,Tính nồng độ phần trăm của dung dịch thu được sau phản ứng.
\(n_{Fe_2O_3}=\dfrac{4}{160}=0,025\left(mol\right)\)
PTHH: Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Mol: 0,025 0,075 0,025
\(m_{ddH_2SO_4}=\dfrac{0,075.98.100}{9,8}=75\left(g\right)\)
mdd sau pứ = 4 + 75 = 79 (g)
\(C\%_{ddFe_2\left(SO_4\right)_3}=\dfrac{0,025.400.100\%}{79}=12,66\%\)
Đúng 1
Bình luận (0)
Cho 11,2 g sắt tác dụng với 9,6g lưu huỳnh. Phản ứng xảy ra hoàn toàn thu được hỗn hợp A. Hòa tan hỗn hợp A bằng m gam dd H2SO4 đặc, nóng thì thu được V lít khí B và dung dịch C.
1. Tính m và V
2. Cho dung dịch C tác dụng vừa đủ dung dịch Ba(OH)2 . Lọc kết tủa, nung khối lượng đến không đổi được chất rắn D. Tính khối lượng D?
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right);n_S=\dfrac{9,6}{32}=0,3\left(mol\right)\)
PTHH: \(Fe+S-^{t^o}\rightarrow FeS\)
Theo đề: 0,2...0,3
Lập tỉ lệ \(\dfrac{0,2}{1}< \dfrac{0,3}{1}\)=> Fe hết. S dư
=> Sau phản ứng hỗn hợp gồm S dư, FeS
=> \(n_{S\left(dư\right)}=0,3-0,2=0,1\left(mol\right)\)
S + H2SO4 → SO2 + H2O
2FeS + 10H2SO4 → Fe2(SO4)3 + 9SO2 + 10H2O
\(\Rightarrow m_{H_2SO_4}=\left(0,1+\dfrac{0,2.10}{2}\right).98=107,8\left(g\right)\)
\(V_{SO_2}=\left(0,1+\dfrac{0,2.9}{2}\right).22,4=22,4\left(l\right)\)
\(n_{Fe_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{FeS}=0,1\left(mol\right)\)
3Ba(OH)2 + Fe2(SO4)3 → 2Fe(OH)3↓ + 3BaSO4↓ (*)
Fe(OH)3 ---to→ Fe2O3 + H2O (**)Theo PT (*) : \(n_{Fe_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Fe\left(OH\right)_3}=0,05\left(mol\right)\)
Theo PT (**): \(n_{Fe_2O_3}=2n_{Fe\left(OH\right)_3}=0,1\left(mol\right)\)
\(\Rightarrow m_{Fe_2O_3}=0,1.160=16\left(g\right)\)
Đúng 2
Bình luận (0)
hòa tan hoàn toàn 0,56g sắt bằng dung dịch H2SO4 loãng 19,6% vừa đủ
a, viết PTHH
b, tính khối lượng muối tạo thành và thể tích khí hidro sinh ra (đktc)
c, cần bao nhiêu gam dung dịch H2SO4 loãng nói trên để hòa tan sắt ?
giúp mình vớiiii
a, \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Ta có: \(n_{Fe}=\dfrac{0,56}{56}=0,01\left(mol\right)\)
Theo PT: \(n_{H_2SO_4}=n_{FeSO_4}=n_{H_2}=n_{Fe}=0,01\left(mol\right)\)
b, \(m_{FeSO_4}=0,01.152=1,52\left(g\right)\)
\(V_{H_2}=0,01.22,4=0,224\left(l\right)\)
c, \(m_{ddH_2SO_4}=\dfrac{0,01.98}{19,6\%}=5\left(g\right)\)
Đúng 2
Bình luận (0)
Hòa tan hết m gam hỗn hợp Fe, Zn bằng dung dịch H2SO4 10% vừa đủ, thu được dung dịch có nồng độ phần trăm của muối sắt là 4,87%. Nồng độ phần trăm của muối kẽm trong dung dịch là: A. 10,32% B. 8,72% C. 10,95% D. 10,30%
Đọc tiếp
Hòa tan hết m gam hỗn hợp Fe, Zn bằng dung dịch H2SO4 10% vừa đủ, thu được dung dịch có nồng độ phần trăm của muối sắt là 4,87%. Nồng độ phần trăm của muối kẽm trong dung dịch là:
A. 10,32%
B. 8,72%
C. 10,95%
D. 10,30%
Đặt nFe = x,nZn = y.
Khối lượng dung dịch sau phản ứng là 56x+65y+980(x+y) - 2(x+y) = 1034x+1043y
%khối lượng muối sắt = 152x/(1034x+1043y)
=> y=2x
=> % khối lượng muối kẽm = 161y/(1034x+1043y) = 10,32%
=> Đáp án A
Đúng 0
Bình luận (0)
/ Hòa tan hoàn toàn 10,8 gam nhôm bằng dung dịch H2SO4 loãng 9,8% vừa đủ. a) Viết phương trình hóa học. b) Tính thể tích khí hiđro sinh ra (đktc). c) Tính nồng độ phần trăm của dung dịch muối thu được sau phản ứng.
\(n_{Al}=\dfrac{10,8}{27}=0,4(mol)\\ a,2Al+3H_2SO_4\to Al_2(SO_4)_3+3H_2\\ \Rightarrow n_{H_2}=n_{H_2SO_4}=0,6(mol);n_{Al_2(SO_4)_3}=0,2(mol)\\ b,V_{H_2}=0,6.22,4=13,44(l)\\ c,m_{dd_{H_2SO_4}}=\dfrac{0,6.98}{9,8\%}=600(g)\\ \Rightarrow C\%_{Al_2(SO_4)_3}=\dfrac{0,2.342}{10,8+600-0,6.2}.100\%=11,22\%\)
Đúng 2
Bình luận (1)
a) \(n_{Al}=\dfrac{m}{M}=\dfrac{10,8}{27}=0,4\left(\text{mol}\right)\)
Phương trình hóa học phản ứng
2Al + 3H2SO4 ---> Al2(SO4)3 + 3H2
2 : 3 : 1 : 3
0,4 0,6 0,2 0,6
mol mol mol mol
Thể tích khí H2 sinh ra là
\(V=n.22,4=0,6.22,4=13,44\left(l\right)\)
\(m_{Al_2\left(SO_4\right)_3}=n.M=0,2.342=68,4\left(g\right)\)
\(m_{H_2SO4}=n.M=0,6.98=58,8\left(g\right)\)
\(m_{H_2}=n.M=0,6.2=1,2\left(g\right)\)
=> \(m_{ddH_2SO_4}=\dfrac{m_{H_2SO_4}.100\%}{C\%}=\dfrac{58,8.100\%}{9,8\%}=600\)(g)
=> \(m_{\text{dd sau pư}}=m_{ddH_2SO_4}+m_{Al}-m_{H_2}\)
= 600 + 10,8 - 1,2 (g) = 609,6 (g)
=> \(C\%_{Al_2\left(SO_4\right)_3}=\dfrac{m_{Al_2\left(SO_4\right)_3}}{m_{\text{dd sau pư}}}.100\%=\dfrac{68,4}{609,6}.100\%\)=11,22%
Đúng 0
Bình luận (0)