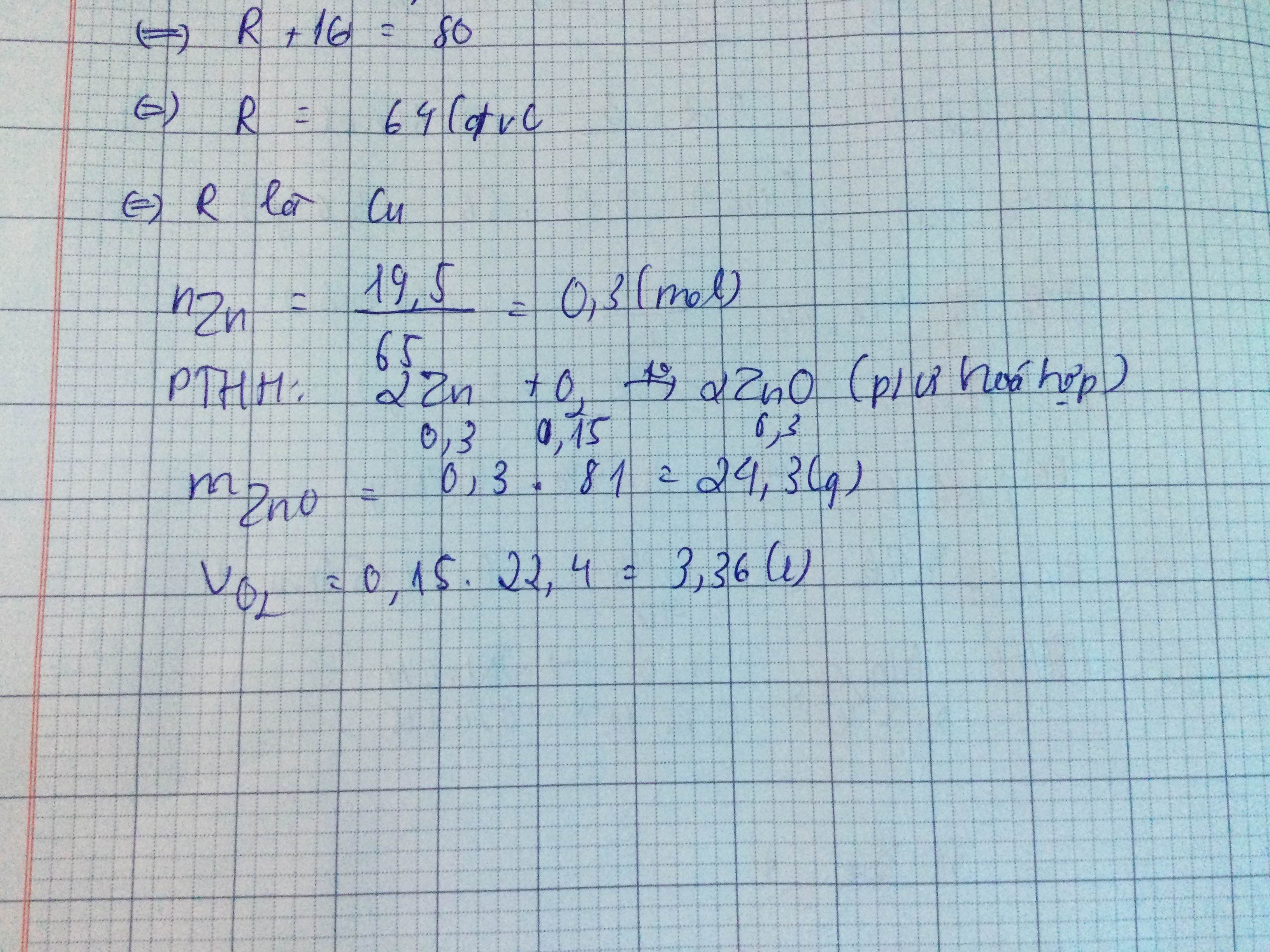Dẫn 2,24l (đktc) khí CO2 vào 100ml đ NaOH 1M, Muối nào đc tạo ra. Viết PTHH của phản ứng

Những câu hỏi liên quan
Cho 12,6g muối Na2SO3 tác dụng với1 lượng vừa đủ dd axit H2SO4 thì thu đc khí A. Dẫn toàn bộ khí A vào 1,4 lít đ Ca(OH)2 0,1M
a) Tính thể tích khí A đktc?
b) Tính khối lượng các chất sau phản ứng
a) PTHH: \(Na_2SO_3+H_2SO_4\rightarrow Na_2SO_4+H_2O+SO_2\uparrow\)
Ta có: \(n_{Na_2SO_3}=\dfrac{12,6}{126}=0,1\left(mol\right)=n_{SO_2}\) \(\Rightarrow V_{SO_2}=0,1\cdot22,4=2,24\left(l\right)\)
b) Ta có: \(\left\{{}\begin{matrix}n_{SO_2}=0,1\left(mol\right)\\n_{Ca\left(OH\right)_2}=1,4\cdot0,1=0,14\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Tạo muối trung hòa
PTHH: \(Ca\left(OH\right)_2+SO_2\rightarrow CaSO_3\downarrow+H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{CaSO_3}=0,1\left(mol\right)=n_{Ns_2SO_4}\\n_{Ca\left(OH\right)_2\left(dư\right)}=0,04\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{CaSO_3}=0,1\cdot120=12\left(g\right)\\m_{Na_2SO_4}=0,1\cdot142=14,2\left(g\right)\\m_{Ca\left(OH\right)_2\left(dư\right)}=0,04\cdot74=2,96\left(g\right)\end{matrix}\right.\)
Đúng 1
Bình luận (0)
\(n_{Na_2SO_3}=0,1\left(mol\right)\\ PTHH:Na_2SO_3+H_2SO_4\rightarrow Na_2SO_4+H_2O+SO_2\)
(mol) 0,1 0,1 0,1 0,1
\(a.V_{SO_2}=0,1.22,4=2,24\left(l\right)\)
\(b.n_{Ca\left(OH\right)_2}=0,14\left(mol\right)\)
Do \(\dfrac{n_{OH}}{n_{SO_2}}=\dfrac{0,28}{0,1}=2.8>2\rightarrow\) Tạo muối trung hòa và Ca(OH)2 dư 0,04(mol)
\(PTHH:Ca\left(OH\right)_2+SO_2\rightarrow CaSO_3+H_2O\)
(mol) 0,1 0,1 0,1 0,1
\(m_{Ca\left(OH\right)_2\left(du\right)}=0,04.74=2,96\left(g\right)\\ m_{CaSO_3}=12\left(g\right)\\ m_{H_2O}=0,1.18=1,8\left(g\right)\)
Đúng 1
Bình luận (0)
Nung 13,4 gam hỗn hợp 2 muối cacbonat của 2 kim loại hóa trị 2, thu được 6,8 gam chất rắn và khí X. Lượng khí X sinh ra cho hấp thụ vào 75ml dung dịch NaOH 1M. Khối lượng muối khan thu được sau phản ứng là:
A. 5,8 g
B. 6,5 g
C. 4,2 g
D. 6,3 g
Đáp án D
Gọi công thức chung của hai muối cacbonat kim loại hóa trị II là RCO3
RCO3 → RO + CO2
Áp dụng định luật bảo toàn khối lượng ta có:
mCO2 = mRCO3 - mRO = 13,4 - 6,8 = 6,6 (g)
⇒ nCO2 = 0,15 mol
Ta có: nNaOH = 0,075 mol
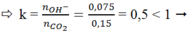
ð tạo ra muối NaHCO3 và CO2 dư.
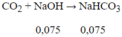
⇒mmuối = 0,075.84 = 6,3(g)
Đúng 0
Bình luận (0)
Câu 1 cho 3,36l khí Co2 vào 100ml dung dịch NaOH 1M . Xác định muối thu được sau phản ứng và tính khối lượng mỗi muối?
Câu2: Cho 2,24l khí Co2 vào 200ml dung dịch NaOH 0,5M. Xác định muối và tính khối lượng muối sau phản ứng?
Câu 3: Sục 4,4l Co2 vào 200 ml dung dịch NaOH 0,5 mol. xác định muối và tính khối lượng muối thu được
Câu 1:
nCO2=\(\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
nNaOH=0,1.1=0,1(mol)
Vì nNaOH<nCO2\(\Rightarrow\)Tạo muối axit
pthh:
CO2+NaOH\(\rightarrow\)NaHCO3
Xét tỉ số: \(\dfrac{0,15}{1}>\dfrac{0,1}{1}\Rightarrow CO2dư\)
Theo pthh:nNaHCO3=nNaOH=0,1(mol)
mNaHCO3=0,1.84=8,4(g)
Chúc bạn học tốt!
Đúng 0
Bình luận (0)
Câu 2:
nCO2=\(\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
nNaOH=0,5.0,2=0,1(mol)
Vì nNaOH\(\le\)nCO2\(\Rightarrow\)Tạo muối axit
pthh:
CO2+NaOH\(\rightarrow\)NaHCO3
0,1.........................0,1(mol)
\(\Rightarrow\)mNaHCO3=0,1.84=8,4(g)
Chúc bạ học tốt!
Đúng 0
Bình luận (0)
3.
nCO2=0,2(mol)
nNaOH=0,1(mol)
Vì \(\dfrac{n_{NaOH}}{n_{CO2}}=\dfrac{0,1}{0,2}< 1\)nên chỉ sinh ra NaHCO3
NaOH + CO2 -> NaHCO3
Theo PTHH ta có:
nNaOH=nNaHCO3=0,1(mol)
mNaHCO3=84.0,1=8,4(g)
Đúng 0
Bình luận (0)
Bài
a, Dẫn 1,68 lít CO2 ở (đktc) sục vào 250 ml dung dịch KO dư. Tính CM của KOH đã phản ứng và của muối tạo thành?
b, Dẫn 28 lít CO2 ở (đktc) vào 300g dung dịch KOH 23%. Tính C% của muối tạo thành?
c, Cho 448 ml CO2 ở (đktc) vào bình chứa 100ml dung dịch NaOH 0,25M. Tính khối lượng muối tạo thành?
a) CO2+2KOH----->K2CO3+H2O
n CO2=1,68/22,4=0,075(mol)
Theo pthh
n KOH=2n CO2=0,15(mol)
CM KOH=0,15/0,25=0,6(M)
b) CO2+2KOH---->K2CO3+H2O(1)
CO2+KOH--->KHCO3(2)
n CO2=28/22,4=1,25(mol)
m KOH=300.23/100=69(g)
n KOH=69/56=1,23(mol)
-->1,23/1,25<1
Tạo 1 muối axit -->xảy ra pư 2
Theo pthh
n KHCO3=n KOH=1,23(mol)
m KHCO3=1,23.100=123(g)
m dd sau pư=300+(1,25.80)=400(g)
C% KHCO3=123/400.100%=30,75%
Chúc bạn học tốt
/ Đốt cháy hoàn toàn 19,5g Zn trong khí oxi thu được ZnO.
a/ Viết PTHH. Phản ứng trên thuộc loại phản ứng nào?
b/ Tính khối lượng ZnO tạo thành
c/ Tính thể tích O2 PƯ
\(n_{Zn}=\dfrac{m_{Zn}}{M_{Zn}}=\dfrac{19,5}{65}=0,3mol\)
\(Zn+\dfrac{1}{2}O_2\rightarrow\left(t^o\right)ZnO\)
1 1/2 1 (mol)
0,3 0,15 0,3 ( mol )
PƯ trên thuộc loại phản ứng hóa hợp
\(m_{ZnO}=n_{ZnO}.M_{ZnO}=0,3.81=24,3g\)
\(V_{O_2}=n_{O_2}.22,4=0,15.22,4=3,36l\)
Đúng 2
Bình luận (4)
a. \(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\)
PTHH : 2Zn + O2 -> 2ZnO ( Phản ứng hóa hợp )
0,3 0,15 0,3
b. \(m_{ZnO}=0,3.81=24,3\left(g\right)\)
c. \(V_{O_2}=0,15.22,4=3,36\left(l\right)\)
Đúng 1
Bình luận (1)
Đốt cháy 9,7g ZnS trong 4,48 lít khí oxi (đktc) tì tạo thành kẽm oxit và khí sunfuro (SO2)
a) viết PTHH của phản ứng
b) chất nào dư và dư bao nhiêu?
c) Tính thể tích khí sunfuro tạo thành
a. PTHH: \(2ZnS+3O_2\underrightarrow{t^o}2ZnO+2SO_2\\ 0,1mol:0,15mol\rightarrow0,1mol:0,1mol\)
b. \(n_{ZnS}=\dfrac{9,7}{97}=0,1\left(mol\right)\)
\(n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Ta có tỉ lệ: \(\dfrac{0,1}{2}< \dfrac{0,2}{3}\)
Vậy ZnS phản ứng hết, Oxi phản ứng dư.
\(n_{O_2du}=0,2-0,15=0,5\left(mol\right)\)
c. \(V_{SO_2}=0,1.22,4=2,24\left(l\right)\)
Đúng 0
Bình luận (0)
\(n_{ZnS}=\dfrac{9,7}{97}=0,1\left(mol\right)\)
\(n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
a. PTHH: \(2ZnS+3O_2-t^o->2ZnO+2SO_2\)
b. Theo PT ta lập tỉ lệ:
\(\dfrac{0,1}{2}< \dfrac{0,2}{3}\Rightarrow\) \(O_2\) dư. ZnS hết => tính theo \(n_{ZnS}\)
Theo PT: \(n_{O_2\left(pư\right)}=\dfrac{0,1.3}{2}=0,15\left(mol\right)\)
\(\Rightarrow n_{O_2\left(dư\right)}=0,1-0,15=0,05\left(mol\right)\)
\(\Rightarrow m_{O_2\left(dư\right)}=0,05.32=1,6\left(g\right)\)
c. Theo PT ta có: \(n_{SO_2}=n_{ZnS}=0,1\left(mol\right)\)
\(\Rightarrow V_{SO_2}=0,1.22,4=2,24\left(l\right)\)
Đúng 0
Bình luận (1)
a) \(2ZnS+3O_2\underrightarrow{t^0}2ZnO+2SO_2\)
b) \(n_{ZnS}=\dfrac{9,7}{97}=0,1\left(mol\right)\)
\(n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo PT:
\(\left\{{}\begin{matrix}\dfrac{n_{ZnS}}{2}=\dfrac{0,1}{2}=0,05\\\dfrac{n_{O_2}}{3}=\dfrac{0,2}{3}=\dfrac{1}{15}\end{matrix}\right.\) \(\Rightarrow\) ZnS phản ứng hết. O2 dư như vậy tính toán theo \(n_{ZnS}\)
Theo PTHH: \(n_{ZnS}:n_{O_2}=2:3\Rightarrow n_{O_2}=n_{ZnS}.\dfrac{3}{2}=0,1.\dfrac{3}{2}=0,15\left(mol\right)\)
\(\Rightarrow n_{O_2\left(dư\right)}=n_{O_2\left(bđ\right)}-n_{O_2\left(pư\right)}=0,2-0,15=0,05\left(mol\right)\)
\(\Rightarrow m_{O_2\left(dư\right)}=0,05.32=1,6\left(g\right)\)
c) Theo PTHH: \(n_{SO_2}:n_{ZnS}=1:1\)
\(\Rightarrow n_{SO_2}=n_{ZnS}=0,1\left(mol\right)\)
\(\Rightarrow V_{SO_2}=0,1.22,4=2,24\left(l\right)\)
Đúng 0
Bình luận (0)
Dẫn 112ml khí SO2 ở (đktc) vào 70ml dung dịch KOH 1M. Hỏi sau phản ứng muối nào tạo thành và khối lượng là bao nhiêu?
\(nSO_2=0,005mol\)
\(nKOH=0,07\)
Ta thấy \(\dfrac{nKOH}{nSO_2}=14\rightarrow\) tạo muối \(K_2SO_3\) và \(KOH\) dư
\(2KOH+SO_2\rightarrow K_2SO_3+H_2O\)
\(0,01.........0,005\)
\(nK_2SO_3=0,005\rightarrow m=0,79\)
Đúng 0
Bình luận (0)
Dẫn từ từ V lít khí CO ở (đktc) đi qua một ống sứ đựng lượng dư hỗn hợp rắn gồm CuO, Fe2O3 (ở nhiệt độ cao). Sau khi các phản ứng xảy ra hoàn toàn, thu được khí X. Dẫn toàn bộ khí X ở trên vào lượng dư dung dịch Ca(OH)2 thì tạo thành 4 gam kết tủa. V có giá trị là: A. 1,120 B. 0,896 C. 0,448 D. 0,224
Đọc tiếp
Dẫn từ từ V lít khí CO ở (đktc) đi qua một ống sứ đựng lượng dư hỗn hợp rắn gồm CuO, Fe2O3 (ở nhiệt độ cao). Sau khi các phản ứng xảy ra hoàn toàn, thu được khí X. Dẫn toàn bộ khí X ở trên vào lượng dư dung dịch Ca(OH)2 thì tạo thành 4 gam kết tủa. V có giá trị là:
A. 1,120
B. 0,896
C. 0,448
D. 0,224
Đáp án B
Ta có:
![]()
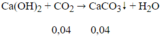
Trong phản ứng khử CuO, Fe2O3 bằng CO, ta luôn có:
nCO = nCO2 = 0,04 mol
⇒VCO = 0,04.22,4 = 0,896 lít
Đúng 0
Bình luận (0)
Câu 4 (4 điểm):Biết rằng kim loại kẽm tác dụng với axit clohiđric (HCl) tạo ra muối kẽm clorua (ZnCl2) và khí hiđro (H2). a. Lập PTHH của phản ứng b. Cho biết tỉ lệ số nguyên tử kẽm lần lượt với số phân tử của ba chất khác trong phản ứng.
Đọc tiếp
Câu 4 (4 điểm):
Biết rằng kim loại kẽm tác dụng với axit clohiđric (HCl) tạo ra muối kẽm clorua (ZnCl2) và khí hiđro (H2). a. Lập PTHH của phản ứng
b. Cho biết tỉ lệ số nguyên tử kẽm lần lượt với số phân tử của ba chất khác trong phản ứng.
\(a,Zn+2HCl\rightarrow ZnCl_2+H_2\)
b, Tỉ lệ số nguyên tử Kẽm : Số phân tử Axit Clohidric = 1:2
Tỉ lệ số nguyên tử Kẽm : Số phân tử Kẽm Clorua = 1:1
Tỉ lệ số nguyên tử kẽm ; Số phân tử khí Hidro = 1:1
Dạng này khá cơ bản, em coi không hiểu hỏi lại nhé!
Đúng 4
Bình luận (0)