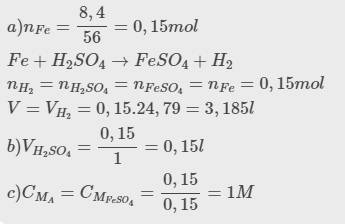3. xác định nồng độ % của dung dịch h2so4 thu được khi hòa tan 3,36 l so3 ở đkc trong 740,4 h20

Những câu hỏi liên quan
Hòa tan 2,7 g kim loại R (III) bằng 1 lượng vừa đủ dung dịch H2SO4 19,6%, thu được 3,7185 L khí không màu (đkc).
a) Xác định R.
b) Tính nồng độ % của đ thu được.
a) $n_{H_2} = \dfrac{3,7185}{24,79} = 0,15(mol)$
$2R + 3H_2SO_4 \to R_2(SO_4)_3 + 3H_2$
Theo PTHH : $n_R = \dfrac{2}{3}n_{H_2} = 0,1(mol)$
$\Rightarrow R = \dfrac{2,7}{0,1} = 27(Al)$
b) $n_{H_2SO_4} = 0,15(mol) \Rightarrow m_{dd\ H_2SO_4} = \dfrac{0,15.98}{19,6\%} = 75(gam)$
$m_{dd\ sau\ pư} = 2,7 + 75 - 0,15.2 = 77,4(gam)$
$n_{Al_2(SO_4)_3} = 0,05(mol)$
$\Rightarrow C\%_{Al_2(SO_4)_3} = \dfrac{0,05.342}{77,4}.100\% = 22,9\%$
Đúng 1
Bình luận (0)
Câu 2. Hòa tan hoàn toàn 0,2 mol NaOH vào 500 ml H20 thu được dung dịch B. Tính nồng độ %, nồng độ mol/l của dung dịch B Câu 3. Hòa tan hoàn toàn 2,8 gam KOH và 5,85 gam NaCl vào 600 ml H20 thu được dung dịch C. Tính nồng độ %, nồng độ mol/l của dung dịch C Câu 4. Hoà tan hoàn toàn 4,6 gam Na vào 100 gam H20 thu được dung dịch D. Tính nồng độ %, nồng độ mol/l của dung dịch D Câu 5. Hòa tan hoàn toàn 2,74 gam Ba vào 200 gam H2O thu được dung dịch E. Tính nồng độ %, nồng độ mol/l của dung dịch E...
Đọc tiếp
Câu 2. Hòa tan hoàn toàn 0,2 mol NaOH vào 500 ml H20 thu được dung dịch B. Tính nồng độ %, nồng độ mol/l của dung dịch B Câu 3. Hòa tan hoàn toàn 2,8 gam KOH và 5,85 gam NaCl vào 600 ml H20 thu được dung dịch C. Tính nồng độ %, nồng độ mol/l của dung dịch C Câu 4. Hoà tan hoàn toàn 4,6 gam Na vào 100 gam H20 thu được dung dịch D. Tính nồng độ %, nồng độ mol/l của dung dịch D Câu 5. Hòa tan hoàn toàn 2,74 gam Ba vào 200 gam H2O thu được dung dịch E. Tính nồng độ %, nồng độ mol/l của dung dịch E Câu 6. Hòa tan hoàn toàn 5,85 gam K và 13,7 gam Ba vào 400 ml H2O thu được dung dịch F, Tính nồng độ %, nồng độ mol/l của dung dịch
Hòa tan 320 g SO3 vào 480 ml nước. Hãy xác định nồng độ phần trăm của dung dịch thu được ? Nêu hiện tượng xảy ra khi nhúng quỳ tím vào dung dịch thu được ?
PTHH: \(SO_3+H_2O\rightarrow H_2SO_4\)
Ta có: \(n_{SO_3}=\dfrac{320}{80}=4\left(mol\right)=n_{H_2SO_4}\) \(\Rightarrow C\%_{H_2SO_4}=\dfrac{4\cdot98}{320+480}\cdot100\%=49\%\)
Dung dịch sau p/ứ làm quỳ tím hóa đỏ
Đúng 3
Bình luận (0)
gì mà 4 mol SO3 lận z
nSO3=4(mol)
PTHH: SO3 + H2O -> H2SO4
mH2O=480(g) => mddH2SO4=mSO3 + mH2O=800(g)
nH2SO4=nSO3=4(mol) => mH2SO4=392(g)
=> C%ddH2SO4= (392/800).100=49%
=> QUỲ TÍM HÓA ĐỎ LÈ LÈ NÈ
Đúng 2
Bình luận (0)
Hòa tan vừa hết 8,4 gam kim loại iron vào dung dịch acid H₂SO₄ 1M. Sau phản ứng thu được dung dịch A và có V lít khí thoát ra (đo ở đkc).
a) Tính V?
b) Tính thể tích dung dịch H2SO4 đã dùng.
c) Xác định nồng độ mol/lít của dung dịch A (coi thể tích dung dịch thay đổi không đáng kể)
Giải chi tiết
Hòa tan 12 gam SO3 vào 100g nước để được dung dịch H2SO4. Tính nồng độ phần trăm của dung dịch H2SO4 thu được
\(SO_3+H_2O\rightarrow H_2SO_4\)
\(n_{SO_3}=\dfrac{12}{80}=0,15\left(mol\right)\)
Theo PT: \(n_{H_2SO_4}=n_{SO_3}=0,15\left(mol\right)\)
\(\Rightarrow C\%_{H_2SO_4}=\dfrac{0,15.98}{12+100}.100\%=13,125\%\)
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn 32gam SO3 vào 200gam dung dịch H2SO4 có nồng độ 10%. Tính C% của dung dịch thu được.
\(n_{SO_3}=\dfrac{32}{80}=0,4\left(mol\right)\)
PTHH: \(SO_3+H_2O\rightarrow H_2SO_4\)
\(n_{H_2SO_4}=n_{SO_3}=0,4\left(mol\right)\)
\(m_{H_2SO_4}=0,4\cdot98=39,2\left(g\right)\)
\(m_{H_2SO_4\text{ trong dd 10%}}=\dfrac{200\cdot10}{100}=20\left(g\right)\)
\(\sum m_{H_2SO_4}=20+39,2=59,2\left(g\right)\)
\(m_{\text{ dd H2SO4 10%}}=200+39,2=239,2\left(g\right)\)
\(C\%_{\text{ dd mới}}=\dfrac{59,2}{239,2}\cdot100\%\approx24,75\%\)
Hiện tượng: SO3 được đưa vào dd H2SO4, SO3 tác dụng với H2O trong dd tạo ra sản phẩm là H2SO4.
Đúng 1
Bình luận (0)
Câu 3: Cho bột sắt vào 800ml dung dịch H2SO4 thu được 3,36 lít H2 ở đktc
a. Tính khối lượng sắt đã phản ứng
b. Xác định nồng độ mol của dung dịch H2SO4 đã dùng ?
\(n_{H_2}=\dfrac{3,36}{22,4}=0,,15(mol)\\ Fe+H_2SO_4\to FeSO_4+H_2\\ \Rightarrow n_{Fe}=n_{H_2SO_4}=0,15(mol)\\ a,m_{Fe}=0,15.56=8,4(g)\\ b,C_{M_{H_2SO_4}}=\dfrac{0,15}{0,8}=0,1875M\)
Đúng 1
Bình luận (0)
Câu 3: Cho bột sắt vào 800ml dung dịch H2SO4 thu được 3,36 lít H2 ở đktc
a. Tính khối lượng sắt đã phản ứng
b. Xác định nồng độ mol của dung dịch H2SO4 đã dùng ?
Câu 3 :
\(n_{H2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Pt : \(Fe+H_2SO_4\rightarrow FeSO_4+H_2|\)
1 1 1 1
0,15 0,15 0,15
a) \(n_{Fe}=\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
⇒ \(m_{Fe}=0,15.56=8,4\left(g\right)\)
b) \(n_{H2SO4}=\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
800ml = 0,8l
\(C_{M_{ddH2SO4}}=\dfrac{0,15}{0,8}=0,1875\left(M\right)\)
Chúc bạn học tốt
Đúng 0
Bình luận (0)
Câu 3: Cho bột sắt vào 800ml dung dịch H2SO4 thu được 3,36 lít H2 ở đktca. Tính khối lượng sắt đã phản ứngb. Xác định nồng độ mol của dung dịch H2SO4 đã dùng ?
Đọc tiếp
Câu 3: Cho bột sắt vào 800ml dung dịch H2SO4 thu được 3,36 lít H2 ở đktc
a. Tính khối lượng sắt đã phản ứng
b. Xác định nồng độ mol của dung dịch H2SO4 đã dùng ?
|
|
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
a) \(n_{Fe}=n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ \Rightarrow m_{Fe}=0,15.56=8,4\left(g\right)\)
b) \(n_{H_2SO_4}=n_{HCl}=0,15\left(mol\right)\\ \Rightarrow CM_{H_2SO_4}=\dfrac{0,15}{0,8}=0,1875M\)
Đúng 1
Bình luận (1)