Khử 21,7 gam thủy ngân (II) oxit bằng hiđro. Hãy:
a. Tính số gam thủy ngân thu được;
b. Tính số mol và thể tích khí hiđro (đktc) cần dùng.
Khử 21,7 gam thủy ngân(II) oxit bằng hiđro. Hãy:
a) Tính số gam thủy ngân thu được.
b) Tính số mol và thể tích khí hiđro (đktc) cần dùng.
nHgO = 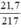 = 0,1 mol.
= 0,1 mol.
Phương trình hóa học của phản ứng khử HgO:
HgO + H2 → Hg + H2O
nHg = 0,1 mol.
mHg = 0,1 .201 = 20,1g.
nH2 = 0,1 mol.
VH2 = 0,1 .22,4 =2,24l.
Khử 21,7 gam thủy ngân (II) oxit bằng hiđro. Hãy:
a. Tính số gam thủy ngân thu được;
b. Tính số mol và thể tích khí hiđro (đktc) cần dùng.
a. Số mol thủy ngân (II) oxit là: n = \(\frac{m}{M}\) = \(\frac{21,7}{217}\) = 0,1 (mol)
phương trình phản ứng:
HgO + H2 → H2O + Hg
1 mol 1 mol 1mol 1 mol
0,1 0,1 0,1 0,1
Khối lượng thủy ngân thu được: m = 0,1.201 = 20,1 (g)
b. Số mol khí hi đro: n = 0,1 mol
Thể tích khí hiđro cần dùng ở đktc là:
V = 22,4.0,1 = 2,24 (lít)
a/ PTHH: HgO + H2 ===> Hg + H2O
nHgO = 21,7 / 217 = 0,1 mol
=> nHg = nHgO = 0,1 mol
=> mHg = 0,1 x 201 = 20,1 gam
b/ Theo phương trình, ta có:
nH2 = nHgO = 0,1 mol
=> VO2(đktc) = 0,1 x 22,4 = 2,24 lít
Khử 21.7g thủy ngân (ii) oxit (HgO) bằng khí H2 thì số gam thủy ngân thu được là bao nhiêu?
PTHH: HgO + \(H_2\) ---> Hg + \(H_2O\)
0,1 mol 0,1 mol 0,1 mol 0,1 mol
+ Số mol của HgO:
\(n_{HgO}\) = \(\dfrac{m}{M}\) = \(\dfrac{21,7}{217}\) = 0,1 (mol)
+ Số g thủy ngân (Hg) thu được:
\(m_{Hg}\) = n . M = 0,1 . 201 = 20,1 (g)
Vậy: thu được 20,1 g Hg (thủy ngân)
\(n_{HgO}=\dfrac{m_{HgO}}{M_{HgO}}=\dfrac{21,7}{217}=0,1\left(mol\right)\)
\(HgO+H_2\underrightarrow{t^0}H_2O+Hg\)
Theo PT: 1mol _ 1mol _ 1mol _ 1mol
Theo đề: 0,1 mol _ 0,1 mol _ 0,1 mol _ 0,1 mol
\(m_{Hg}=n_{Hg}.M_{Hg}=0,1.201=20,1\left(g\right)\)
II- BÀI TẬP TỰ LUẬN :
Bài 1: Viết phương trình hóa học cho các phản ứng giữa hidro và các oxit sau:a. Sắt (III) oxitb. Thủy ngân (II) oxitc. Chì (II) oxit
Bài 2: Khử 48 gam đồng(II) oxit bằng khí hiđro. Hãy:
a) Tính số gam đồng kim loại thu được.
b) Tính thể tích khí hiđro (đktc) cần dùng
Bài 3: Khử 21,7 gam thủy ngân(II) oxit bằng hiđro. Hãy:
a) Tính số gam thủy ngân thu được.
b) Tính số mol và thể tích khí hiđro (đktc) cần dùng
Bài 4: Tính thể tích oxi (đktc) thu được khi phân hủy 4,9 gam KClO3 trong phòng thí
nghiệm?
Bài 5: Tính số gam nước thu được khi cho 8,4 lít khí hiđro tác dụng với 2,8 lít oxi (các thể tích đo ở đktc).
Bài 6: Cho các kim loại kẽm, nhôm, sắt, lần lượt tác dụng với dung dịch H2SO4 loãng.
a, Viết phản ứng hóa học?
b, Cho cùng một khối lượng kim loại trên tác dụng hết với axit thì kim loại nào cho nhiều khí hiđro nhất?
c, Nêú thu được cùng một thể tích khí H2 thì khối lượng của kim loại nào đã phản ứng là nhỏ nhất?
Bài 7: Dẫn 2,24 lít khí H2 ở đktc vào một ống có chứa 12g CuO đã nung nóng tới nhiệt độ thích hợp. Kết thúc phản ứng trong ống còn a(g) chất rắn.
a. Viết phương trình phản ứng.
b. Tính khối lượng nước tạo thành sau phản ứng trên.
c. Tính a.
3.
nHgO = 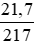
Phương trình hóa học của phản ứng khử HgO:
HgO + H2 → Hg + H2O
nHg = 0,1 mol.
mHg = 0,1 .201 = 20,1g.
nH2 = 0,1 mol.
VH2 = 0,1 .22,4 =2,24l.
1.
Phương trình phản ứng:
Fe3O4 + 4H2 → 4H2O + 3Fe
HgO + H2 → H2O + Hg
PbO + H2 → H2O + Pb
2.
a. Số mol đồng (II) oxit: n = m/M = 48/80 = 0,6 (mol)
Phương trình phản ứng:
CuO + H2 to→ H2O + Cu
1 mol 1 mol 1 mol
0,6 0,6 0,6
Khối lượng đồng kim loại thu được: m = n.M = 0,6.64 = 38,4 (g)
b. Thể tích khí hiđro cần dùng ở đktc là:
V = 22,4.n = 22,4.0,6 = 13,44 (lít).
Khử 21,7 gam thủy ngân có hóa trị 2 oxit bằng khí hidro hãy a Viết phương trình phản ứng trên b thể tích khí hidro điều kiện tiêu chuẩn cần dùng biết Mhg =21, MH =1 Mo=16
\(n_{HgO}=\dfrac{21,7}{217}=0,1mol\)
\(HgO+H_2\rightarrow\left(t^o\right)Hg+H_2O\)
0,1 0,1 ( mol )
\(V_{H_2}=0,1.22,4=2,24l\)
khử 43,4g thủy ngân(II) oxit bằng khí hiđro
a) tính khối lượng thủy ngân thu được
b) tính số mol và thể tích khsi hidro(đktc) cần dùng
\(n_{HgO}=\dfrac{43,4}{217}=0,2\left(mol\right)\)
PTHH: HgO + H2 --to--> Hg + H2O
0,2 0,2 0,2
\(\rightarrow\left\{{}\begin{matrix}m_{Hg}=201.0,2=40,2\left(g\right)\\V_{H_2}=0,2.22,4=4,48\left(l\right)\end{matrix}\right.\)
nHgO = 43,4 : 217 = 0,2 (mol)
pthh : HgO + H2 -t> Hg + H2O
0,2 0,2 0,2
mHg = 0,2 . 201 = 40,2 (G)
VH2 = 0,2 . 22,4 = 4,48 (L)
\(PTHH:HgO+H_2\underrightarrow{t^o}Hg+H_2O\)
\(a,n_{HgO}=\dfrac{m}{M}=\dfrac{43,4}{217}=0,2mol\)
\(\rightarrow n_{Hg}=n_{HgO}=0,2mol\)
\(\Rightarrow m_{Hg}=n.M=0,2.201=40,2g\)
\(b,n_{H_2}=n_{HgO}=0,2mol\)
\(\Rightarrow V_{H_2}=n.22,4=0,2.22,4=4,48l\)
Khử 8,68 gam thủy ngân (II) oxit bằng 0,56 lít khí hiđrô ở nhiệt độ
cao.
a/ Chất nào còn dư sau phản ứng và dư bao nhiêu?
b/ Tính khối lượng kim loại thu được sau phản ứng?
HgO+H2-to>Hg+H2O
0,025-0,025--0,025
n HgO=\(\dfrac{8,68}{217}\)=0,04 mol
n H2=\(\dfrac{0,56}{22,4}\)=0,025 mol
=>HgO dư
=>m Hg=0,025.201=5,025g
nH2 = 0,56/22,4 = 0,025 (mol)
nHgO = 8,68/217 = 0,04 (mol)
PTHH: HgO + H2 -> (t°) Hg + H2O
LTL: 0,025 < 0,04 => H2 dư
nH2 (p/ư) = nHg = 0,025 (mol)
VH2 = (0,04 - 0,025) . 22,4 = 0,336 (l)
mHg = 0,025 . 201 = 5,025 (g)
Viết phương trình hóa học của phản ứng hiđro khử các oxit sau:
a) Sắt (III) oxit.
b) Thủy ngân(II) oxit.
c) Chì(II) oxit.
a) Fe2O3 + 3H2 → 2Fe + 3H2O.
b) HgO + H2 → Hg + H2O.
c) PbO + H2 → Pb + H2O.
Nung nóng thủy ngân ( II ) oxit HgO thì được thủy ngân và oxi . Hãy tính thể tích khí oxi thu được khi nung 54,25g HgO
Ta có : \(n_{HgO}=\frac{54,25}{217}=0,25\left(mol\right)\)
PTHH : \(2HgO\rightarrow2Hg+O_2\uparrow\)
Theo phương trình, ta có : \(n_{O_2}=\frac{1}{2}n_{HgO}\Rightarrow n_{O_2}=0,125\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,125.22,4=2,8\left(l\right)\)