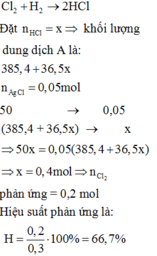Cho 10 lít khí H2 tác dụng với 6,72 liwts Cl2 (đktc ) . Tính khối lượng của HCl thu được , biết hiệu suất phản ứng là 60% và mất mát là 5 %

Những câu hỏi liên quan
cho 10 lít khí H2 tác dụng với 6,72 lít Cl2 (đktc). Tính khối lượng HCl thu được, biết hiệu suất phản ứng là 60% và mất mát là 5%.
Em kiểm tra lại đề nhé. Dữ kiện mất mát 5% hơi mẫu thuẫn. Vì hiệu suất có là 60% nên lượng mất mát đã là 40% rồi
Đúng 0
Bình luận (0)
cho AL tác dụng với HCL thu đc AL2CL3 và 6,72 lít khí H2(đktc). Biết hiệu suất phản ứng là 80%. Tính khối lượng AL và HCL tham gia phản ứng.(mn giúp e với T-T)
PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{Al\left(LT\right)}=\dfrac{2}{3}n_{H_2}=0,2\left(mol\right)\\n_{HCl\left(LT\right)}=2n_{H_2}=0,6\left(mol\right)\end{matrix}\right.\)
Mà: H% = 80%
\(\Rightarrow\left\{{}\begin{matrix}n_{Al\left(TT\right)}=\dfrac{0,2}{80\%}=0,25\left(mol\right)\\n_{HCl\left(TT\right)}=\dfrac{0,6}{80\%}=0,75\left(mol\right)\end{matrix}\right.\)
⇒ mAl = 0,25.27 = 6,75 (g)
mHCl = 0,75.36,5 = 27,375 (g)
Đúng 2
Bình luận (1)
cho 10 lít khí H2 tác dụng với 6,72 lít Cl2 (đktc). Tính khối lượng HCl thu được, biết hiệu suất phản ứng là 60% và mất mát là 5%.Xin cảm ơn
\(H_2+Cl_2\left(0,18\right)\rightarrow2HCl\left(0,36\right)\)
\(n_{H_2}=\frac{10}{22,4}\approx0,446\left(mol\right)\)
\(n_{Cl_2}=\frac{6,72}{22,4}=0,3\left(mol\right)\)
Vì \(\frac{n_{H_2}}{1}=0,446>\frac{n_{Cl_2}}{1}=0,3\) nên ta tính HCl theo Cl2
Số mol Cl2 tham gia phản ứng là: \(0,3.60\%=0,18\left(mol\right)\)
\(\Rightarrow m_{HCl}=0,36.36,5=13,14\left(g\right)\)
\(\Rightarrow m_{HCl\left(conlai\right)}=13,14.\left(100\%-5\%\right)=12,483\left(g\right)\)
Đúng 0
Bình luận (0)
Bài 10. Cho 6,72 lít H2 tác dụng với 4,48 lít Cl2 thu được hỗn hợp khí X. Cho hỗn hợp X tác dụng với dung dịch AgNO3 dư thu được 43,05 gam kết tủa trắng. Tính hiệu suất của phản ứng H2 tác dụng với Cl2?
\(n_{AgCl}=\dfrac{43.05}{143.5}=0.3\left(mol\right)\) \(\Rightarrow n_{HCl}=0.3\left(mol\right)\)
\(n_{HCl}=\dfrac{6.72}{22.4}=0.3\left(mol\right),n_{Cl_2}=\dfrac{4.48}{22.4}=0.2\left(mol\right)\)
\(H_2+Cl_2\underrightarrow{^{^{t^0}}}2HCl\)
\(0.15....0.15.......0.3\)
\(H\%=\dfrac{0.15}{0.2}\cdot100\%=75\%\)
Đúng 2
Bình luận (1)
Cho lượng dư N2 tác dụng với 6,72 lít khí H2(đktc). Biết hiệu suất của phản ứng là 25%, thu được m(gam) NH3. Giá trị của m
$n_{H_2} = \dfrac{6,72}{22,4} = 0,3(mol)$
$n_{H_2\ pư} = 0,3.25\% = 0,075(mol)$
\(N_2 + 3H_2 \buildrel{xt,t^,p}\over\rightleftharpoons 2NH_3\)
Theo PTHH :
$n_{NH_3} = \dfrac{2}{3}n_{H_2\ pư} = 0,05(mol)$
$m = 0,05.17 = 0,85(gam)$
Đúng 2
Bình luận (0)
Cho 10,00 lít H2 và 6,72 lít khí Clo (đktc) tác dụng với nhau rồi hòa tan sản phẩm vào 385,40 gam nước thu được dung dịch A. Lấy 50 gam dung dịch A cho tác dụng với AgNO3 dư thu được 7,175 gam kết tủa. Tính hiệu suất phản ứng giữa H2 và Cl2
\(n_{AgCl}=\dfrac{7,175}{143,5}=0,05\left(mol\right)\)
PTHH: HCl + AgNO3 ---> AgCl↓ + HNO3
0,05<---------------0,05
\(\rightarrow m_{HCl}=0,05.36,5=1,825\left(g\right)\\
\rightarrow C\%_{ddA}=\dfrac{1,825}{50}.100\%=3,65\%\)
\(n_{Cl_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Đặt H = x%
PTHH: Cl2 + H2 --as--> 2HCl
LTL: 6,72 < 10 => H2 dư
=> nHCl = 0,3x (mol)
\(\rightarrow C\%_{HCl}=\dfrac{0,3x.36,5}{0,3x.36,5+385,4}.100\%=3,65\%\\ \Leftrightarrow20,23\%\)
Đúng 2
Bình luận (0)
Cho 10,0 lít H2 và 6,72 lít Cl2 (đktc) tác dụng với nhau rồi hòa tan sản phẩm vào 358,4 gam nước ta thu được dung dịch A. Lấy 50,0 gam dung dịch A tác dụng với dung dịch AgNO3 dư thu được 7,175 gam kết tủa. Hiệu suất của phản ứng giữa H2 và Cl2 là: A. 32,4% B. 20,0% C. 44,8% D. 66,7%
Đọc tiếp
Cho 10,0 lít H2 và 6,72 lít Cl2 (đktc) tác dụng với nhau rồi hòa tan sản phẩm vào 358,4 gam nước ta thu được dung dịch A. Lấy 50,0 gam dung dịch A tác dụng với dung dịch AgNO3 dư thu được 7,175 gam kết tủa. Hiệu suất của phản ứng giữa H2 và Cl2 là:
A. 32,4%
B. 20,0%
C. 44,8%
D. 66,7%
Câu1: Cho 6,72 lít N2 tác dụng với 11,2 lít H2, thu được 13,44 lít hỗn hợp khí. Hiệu suất của phản ứng là (các thể tích khí đo ở đktc)
$N_2 + 3H_2 \buildrel{{t^o,xt,p}}\over\rightleftharpoons 2NH_3$
Ta thấy : $V_{N_2} : 1 > V_{H_2} : 3$ nên $N_2$ dư
Gọi hiệu suất là a
Suy ra : $V_{H_2\ pư} = 11,2a(lít)$
$V_{N_2\ pư} = \dfrac{11,2a}{3}$
$V_{NH_3} = \dfrac{2.11,2a}{3} $
Ta có :
$11,2 - 11,2a + 6,72 - \dfrac{11,2a}{3} + \dfrac{2.11,2a}{3} = 13,44$
$\Rightarrow a = 0,6 =6 0\%$
Đúng 3
Bình luận (0)
Cho lượng dư N2 tác dụng với 10,08 lít khí H2(đktc). Biết hiệu suất của phản ứng là 37%, thu được V lít NH3(đktc). Giá trị của m
$n_{H_2} = \dfrac{10,08}{22,4} = 0,45(mol)$
$n_{H_2\ pư} = 0,45.37\% = 0,1665(mol)$
$N_2 + 3H_2 \buildrel{xt,t^,p}\over\rightleftharpoons 2NH_3$
$n_{NH_3} = \dfrac{3}{2}n_{H_2}= 0,111(mol)$
$V = 0,111.22,4 = 2,4864(lít)$
Đúng 1
Bình luận (0)